Linfoma Non Hodgkin a grandi cellule B, Stadio IV-A-E
Pubblicato il 30/06/2014
Dott. Luigi Pisani
Linfoma Non Hodgkin a grandi cellule B, Stadio IV-A-E: a Case Report Sommario L’autore presenta il caso di una paziente affetta da Linfoma non Hodgkin a grandi cellule B in stadio clinico IV-A (in assenza di sintomi sistemici)-E (le sedi extranodali erano la cute, i reni e verosimilmente la mammella destra)-X (per le dimensioni bulk della lesione cutanea toracica), con indice prognostico elevato secondo l’International Prognostic Index, per la quale fu indicato un programma chemioterapico aggressivo. Il programma terapeutico prevedeva 8 cicli di chemioterapia secondo lo schema MACOP-B al termine del quale, sulla base dei risultati ottenuti, sarebbe stata decisa la successiva strategia terapeutica. Il trattamento fu sospeso per la comparsa di grave tossicità per cui la paziente decise di intraprendere un percorso terapeutico secondo l’MdB.
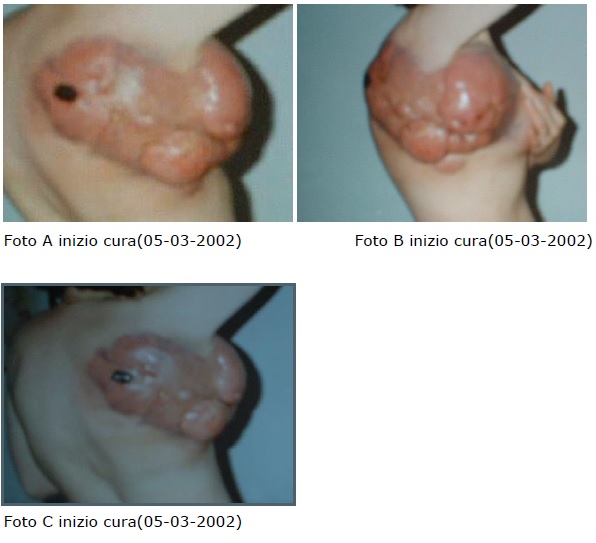
Il quadro clinico giunto alla mia osservazione era il seguente:
Il quadro clinico giunto alla mia osservazione era il seguente:
Introduzione
I LNH costituiscono un gruppo eterogeneo di disordini linfoproliferativi maligni con comportamenti clinici e origini biologiche diversi. L’eziologia della maggior parte dei LNH continua ad essere poco compresa e la loro incidenza aumenta in maniera esponenziale con l’età. I LNH possono presentarsi interessando preferenzialmente diverse sedi anatomiche, essi esordiscono coinvolgendo più stazioni linfonodali e si estendono alla milza, al midollo osseo e agli altri tessuti ed organi. Localizzazioni extralinfatiche primitive si riscontrano nel 20-30% dei casi ed interessano preferenzialmente il tratto gastroenterico, la cute, il sistema nervoso centrale ed i testicoli.
Riguardo l’etiologia una serie di fattori di rischio sono stati associati all’insorgenza del LNH, tra questi: fattori genetici, infezioni, condizioni di immunodeficienza congenita ed acquisita, agenti fisici e chimici.
La classificazione dei LNH è stata modificata diverse volte durante le ultime quattro decadi e questo ha rappresentato una fonte di confusione e frustrazione per i medici. Attualmente sono classificati secondo un sistema denominato REAL (Revised Eureopean-American Classification of Lymphoid Neoplasms) che li suddivide sulla base della loro derivazione dai linfociti B, T o NK.
Dopo aver fatto diagnosi di LNH, è necessario eseguire diversi esami per identificare tutte le sedi di malattia e determinare la prognosi basandosi su noti fattori clinici di rischio. La stadiazione è diventata più accurata e più complicata con l’avvento di esami non invasivi e dalla disponibilità di mezzi più sofisticati come la tomografia ad emissione di positroni (PET). Il sistema di stadiazione di Ann Arbor, originariamente concepito per determinare la diffusione anatomica della Malattia di Hodgkin, rimane il sistema di stadiazione più ampiamente utilizzato per i LNH, nonostante la sua incompletezza.
Nel caso in oggetto trattasi di un Linfoma a grandi cellule B (Diffuse large cell lymphoma, DLCL), che rappresenta il 40% di tutti i linfomi ed è caratterizzato dalla presenza di grandi cellule a fenotipo B con nucleo clivato o multilobato, nucleoli ben evidenti e citoplasma basofilo.
La malattia esordisce con masse sia linfonodali che extralinfonodali a rapida crescita. Spesso le masse linfonodali hanno caratteristiche “bulky”, specie nel mediastino e nell’addome.
I LNH come le altre neoplasie emopoietiche, devono essere considerate malattie sistemiche, quelli primitivi del tratto Gastroenterico, della Cute, del Testicolo ed in particolare del Sistema Nervoso Centrale tendono a rimanere confinati nel tessuto d’origine anche nelle fasi avanzate di malattia.
La terapia mira alla guarigione nei linfomi diffusi ed aggressivi in quanto in questi gruppi di neoplasie è oggi possibile ottenere un’elevata percentuale di remissioni complete durature utilizzando i moderni schemi di polichemioterapia intensiva, compreso il trattamento ad alte dosi con supporto di precursori emopoietici circolanti. Nei linfomi a presentazione indolente non sembra attualmente possibile ottenere una guarigione con i mezzi terapeutici oggi disponibili,probabilmente a causa di uno degli oncogeni della farmaco resistenza (bcl-2), di conseguenza il trattamento mira soprattutto ad un lungo controllo della malattia utilizzando terapie poco aggressive.
Metodo
In considerazione della poco soddisfacente attività dimostrata dalla chemioterapia sistemica ho deciso di instaurare nella paziente un trattamento con Octreotide, Acido all-trans retinoico, Melatonina, Ciclofosfamide, Cabergolina, (CODEX) V Pasta Lenitiva e V10 Oleogel.
Obiettivo della terapia è stato inibire l’angiogenesi sfruttando le potenzialità degli analoghi della Somatostatina e la somministrazione dell’Octreotide fu avvalorata dal fatto che diverse prove avevano confermato che gli analoghi della Somatostatina hanno un’azione antiproliferativa in tumori sperimentali, sebbene non sia ancora completamente chiaro il meccanismo con cui essi esplicano il proprio effetto.
L’inibizione della crescita tumorale può essere dovuta a diversi meccanismi:
-Inibizione dell’angiogenesi e stimolo dell’apoptosi
-Riduzione del flusso ematico nel tumore
-Effetto antiproliferativo diretto tramite il legame con il recettore
-Effetto antiproliferativo indiretto per inibizione del rilascio di fattori di crescita (IGF-1)
-Inibizione degli ormoni come insulina, GH, gastrina, CCK, secretina che regolano la crescita tumorale
-Modulazione dell’attività immunologia
-Effetti diretti antimitotici
L’applicazione per uso topico del (CODEX) V Pasta lenitiva ed il V10 Oleogel, prodotti contenenti sostanze ad azione trofica, cheratoplastica ed attivanti della risposta immune fu ritenuto necessario per usufruire di queste proprietà, cioè riequilibrare e riattivare la risposta immune a livello linfonodale e soprattutto usufruire della potente azione lenitiva e nello stesso tempo anche dell’efficace riattivazione del trofismo dei tessuti.
Risultato
Alla paziente per 36 mesi è stato applicato il trattamento terapeutico precedentemente descritto, associato ad altri farmaci che sono stati modulati nel tempo in rapporto ai follow-up, raccomandati dalle linee guida, periodicamente effettuati.
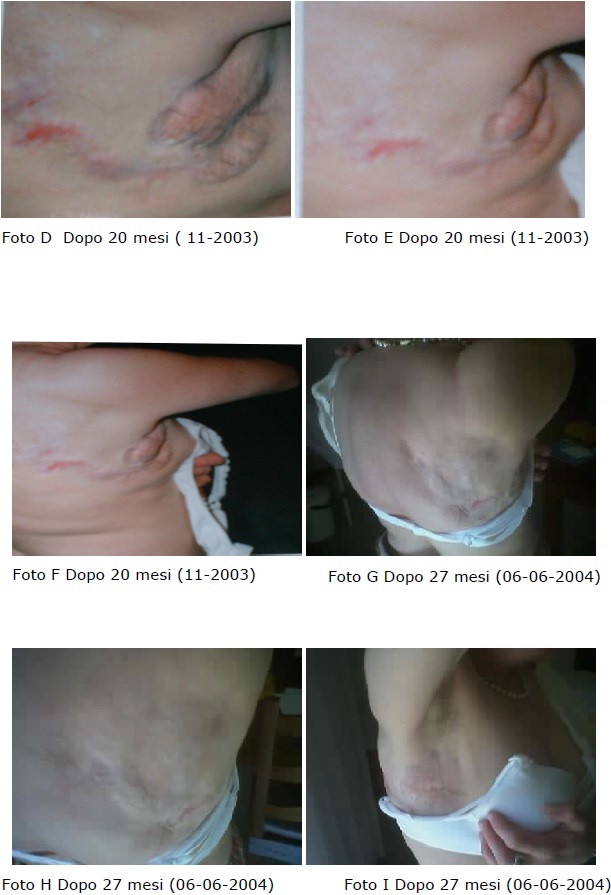
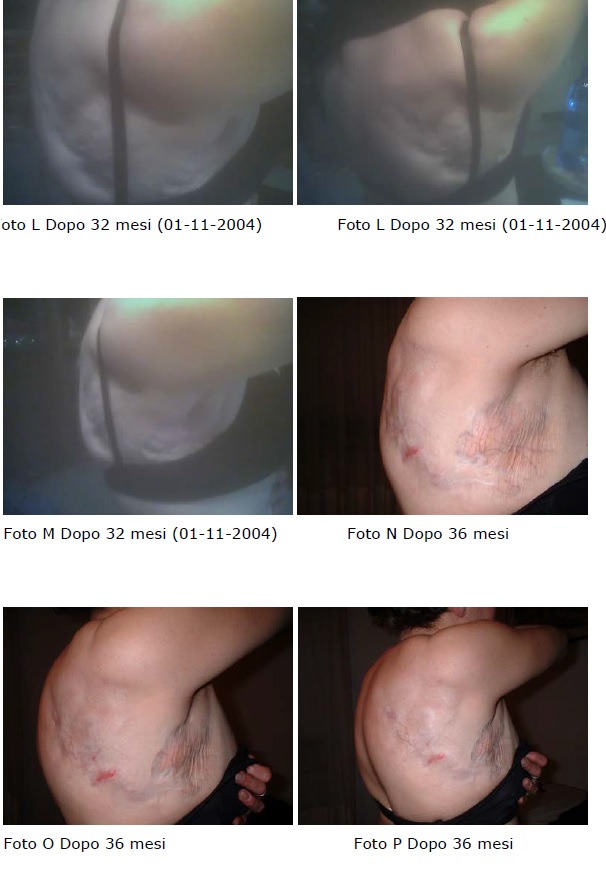
Al controllo si evidenzia in modo significativo la scomparsa delle lesioni cutanee, come documentato dalle immagini,in assenza di effetti collaterali e di tossicià farmacologia.
Nelle immagini successive è possibile evidenziare l’evoluzione progressiva della regressione della lesione:
I LNH costituiscono un gruppo eterogeneo di disordini linfoproliferativi maligni con comportamenti clinici e origini biologiche diversi. L’eziologia della maggior parte dei LNH continua ad essere poco compresa e la loro incidenza aumenta in maniera esponenziale con l’età. I LNH possono presentarsi interessando preferenzialmente diverse sedi anatomiche, essi esordiscono coinvolgendo più stazioni linfonodali e si estendono alla milza, al midollo osseo e agli altri tessuti ed organi. Localizzazioni extralinfatiche primitive si riscontrano nel 20-30% dei casi ed interessano preferenzialmente il tratto gastroenterico, la cute, il sistema nervoso centrale ed i testicoli.
Riguardo l’etiologia una serie di fattori di rischio sono stati associati all’insorgenza del LNH, tra questi: fattori genetici, infezioni, condizioni di immunodeficienza congenita ed acquisita, agenti fisici e chimici.
La classificazione dei LNH è stata modificata diverse volte durante le ultime quattro decadi e questo ha rappresentato una fonte di confusione e frustrazione per i medici. Attualmente sono classificati secondo un sistema denominato REAL (Revised Eureopean-American Classification of Lymphoid Neoplasms) che li suddivide sulla base della loro derivazione dai linfociti B, T o NK.
Dopo aver fatto diagnosi di LNH, è necessario eseguire diversi esami per identificare tutte le sedi di malattia e determinare la prognosi basandosi su noti fattori clinici di rischio. La stadiazione è diventata più accurata e più complicata con l’avvento di esami non invasivi e dalla disponibilità di mezzi più sofisticati come la tomografia ad emissione di positroni (PET). Il sistema di stadiazione di Ann Arbor, originariamente concepito per determinare la diffusione anatomica della Malattia di Hodgkin, rimane il sistema di stadiazione più ampiamente utilizzato per i LNH, nonostante la sua incompletezza.
Nel caso in oggetto trattasi di un Linfoma a grandi cellule B (Diffuse large cell lymphoma, DLCL), che rappresenta il 40% di tutti i linfomi ed è caratterizzato dalla presenza di grandi cellule a fenotipo B con nucleo clivato o multilobato, nucleoli ben evidenti e citoplasma basofilo.
La malattia esordisce con masse sia linfonodali che extralinfonodali a rapida crescita. Spesso le masse linfonodali hanno caratteristiche “bulky”, specie nel mediastino e nell’addome.
I LNH come le altre neoplasie emopoietiche, devono essere considerate malattie sistemiche, quelli primitivi del tratto Gastroenterico, della Cute, del Testicolo ed in particolare del Sistema Nervoso Centrale tendono a rimanere confinati nel tessuto d’origine anche nelle fasi avanzate di malattia.
La terapia mira alla guarigione nei linfomi diffusi ed aggressivi in quanto in questi gruppi di neoplasie è oggi possibile ottenere un’elevata percentuale di remissioni complete durature utilizzando i moderni schemi di polichemioterapia intensiva, compreso il trattamento ad alte dosi con supporto di precursori emopoietici circolanti. Nei linfomi a presentazione indolente non sembra attualmente possibile ottenere una guarigione con i mezzi terapeutici oggi disponibili,probabilmente a causa di uno degli oncogeni della farmaco resistenza (bcl-2), di conseguenza il trattamento mira soprattutto ad un lungo controllo della malattia utilizzando terapie poco aggressive.
Metodo
In considerazione della poco soddisfacente attività dimostrata dalla chemioterapia sistemica ho deciso di instaurare nella paziente un trattamento con Octreotide, Acido all-trans retinoico, Melatonina, Ciclofosfamide, Cabergolina, (CODEX) V Pasta Lenitiva e V10 Oleogel.
Obiettivo della terapia è stato inibire l’angiogenesi sfruttando le potenzialità degli analoghi della Somatostatina e la somministrazione dell’Octreotide fu avvalorata dal fatto che diverse prove avevano confermato che gli analoghi della Somatostatina hanno un’azione antiproliferativa in tumori sperimentali, sebbene non sia ancora completamente chiaro il meccanismo con cui essi esplicano il proprio effetto.
L’inibizione della crescita tumorale può essere dovuta a diversi meccanismi:
-Inibizione dell’angiogenesi e stimolo dell’apoptosi
-Riduzione del flusso ematico nel tumore
-Effetto antiproliferativo diretto tramite il legame con il recettore
-Effetto antiproliferativo indiretto per inibizione del rilascio di fattori di crescita (IGF-1)
-Inibizione degli ormoni come insulina, GH, gastrina, CCK, secretina che regolano la crescita tumorale
-Modulazione dell’attività immunologia
-Effetti diretti antimitotici
L’applicazione per uso topico del (CODEX) V Pasta lenitiva ed il V10 Oleogel, prodotti contenenti sostanze ad azione trofica, cheratoplastica ed attivanti della risposta immune fu ritenuto necessario per usufruire di queste proprietà, cioè riequilibrare e riattivare la risposta immune a livello linfonodale e soprattutto usufruire della potente azione lenitiva e nello stesso tempo anche dell’efficace riattivazione del trofismo dei tessuti.
Risultato
Alla paziente per 36 mesi è stato applicato il trattamento terapeutico precedentemente descritto, associato ad altri farmaci che sono stati modulati nel tempo in rapporto ai follow-up, raccomandati dalle linee guida, periodicamente effettuati.
Al controllo si evidenzia in modo significativo la scomparsa delle lesioni cutanee, come documentato dalle immagini,in assenza di effetti collaterali e di tossicià farmacologia.
Nelle immagini successive è possibile evidenziare l’evoluzione progressiva della regressione della lesione:
Conclusioni
Il risultato ottenuto considerando l’assenza di effetti collaterali appare molto promettente e meritorio di ulteriori studi. Ritengo pertanto che la terapia con protocollo terapeutico secondo l’MdB possa rappresentare una valida alternativa ai trattamenti in uso, soprattutto in relazione al fatto che i chemioterapici antineoplastici, farmaci con indice terapeutico molto stretto, la cui tossicità, riconducibile all’incapacità di discriminare tra cellule normali e cellule tumorali, determinano conseguenze legate al loro uso; essi, infatti, sono responsabili da una parte della comparsa di eventi avversi, anche gravi, con un peggioramento della qualità della vita dei pazienti e dall’altra di un ridotto controllo del tumore e soprattutto perché la comparsa di tossicità, ne limita la dose e pertanto non è possibile raggiungere la dose terapeutica efficace.
Il risultato ottenuto considerando l’assenza di effetti collaterali appare molto promettente e meritorio di ulteriori studi. Ritengo pertanto che la terapia con protocollo terapeutico secondo l’MdB possa rappresentare una valida alternativa ai trattamenti in uso, soprattutto in relazione al fatto che i chemioterapici antineoplastici, farmaci con indice terapeutico molto stretto, la cui tossicità, riconducibile all’incapacità di discriminare tra cellule normali e cellule tumorali, determinano conseguenze legate al loro uso; essi, infatti, sono responsabili da una parte della comparsa di eventi avversi, anche gravi, con un peggioramento della qualità della vita dei pazienti e dall’altra di un ridotto controllo del tumore e soprattutto perché la comparsa di tossicità, ne limita la dose e pertanto non è possibile raggiungere la dose terapeutica efficace.
Bibliografia
Harris NL, Jaffe ES, Stein H: A revised European-American classification of lymphoid neoplasm: a proposal from the International Lymphoma Study Group.Blood 84:1361-1392, 1994
Canellos GP, Lister TA, Skar JL: The lymphomas.Philadelphia,Saunders,1998
Oomen SP,Hofland LJ, van Hagen PM, Lamberts SW & Touw IP(2000) Somatostatin receptors in the haematopoietic system. European Journal of Endocrinology 143 S9-S14
Pollak MN & Schally AV (1998) Mechanism of antineoplastic action of Somatostatin analogs. Proceedings of the Society of Experimental and Biological Medicine 217 143-152
Reubi JC, Schaer JC, Markwalder R, Waswer B, Horisberger U & Laissue J (1997) Distribuzion of Somatostatin receptors in normal and neoplastic human tissues: recent advances and potential relevance. Yale Journal of Biological Medicine 70 471-479
Magrath IT (ed): The Non-Hodgkin’s lymphomas (2 ed).London, Arnold, 1997
Maloney DG: Non-Hodgkin’s lymphoma. Curr Opin Hematol 2 : 255-261, 1995
Schally AV (1998) Oncological applications of somatostatin analogues. Cancer Research 48 6977-6985
Longo DL : Non-Hodgkin’s lymphoma. Curr Opin Hematol 1 :295-302,1994
Skarin AT, Dorfman DM.: Non-Hodgkin’s lymphomas: current classification and management. Cancer J Clin 47: 351-372, 1997
Weckbeker G, raulf F, Stolz B & Bruns C (1993) Somatostatin analogs for diagnosis and treatment of cancer. Pharmacological Therapeutics 60 245-264
Woltering EA, Watson JC, Alperin-Lea RC, Sharma C, Keenan E, Kurozawa D & Barrie R (1997) Somatostatin analogs: Angiogenesis inhibitors with novel mechanims of action. Investigating New Drugs 15 77-86
Somatostatin Immune System and Limphoproliferative Disorders D.Ferone -.Dept. of Endocrine and Metabolic Sciences University of Genova September 18-20,2005 Turin.

