Studio osservazionale retrospettivo su 55 casi di Linfoma
Pubblicato il 29/09/2014
Giuseppe Di Bella*, Biagio Colori+ , Fabrizio Mascia*
* Di Bella Foundation, + Rizzoli” Institute, Scientific Research and Care Institute, Bologna, Italy
Correspondence to: Dr. Giuseppe Di Bella Di Bella Foundation
Via Marconi 51, Post code 40122, Bologna, Italy.
tel: +39 051 239662; +39 051 230369; fax +39 051 2961238;
e-mail: posta@giuseppedibella.it
Key words:: Lymphoma, Di Bella Method (DBM); somatostatin/octreotide; melatonin; retinoids; vitamines E, D3, C; Bromocriptin; Cabergolin.
Abstract
I Linfomi sono la principale forma di neoplasia ematologica: da sole rappresentano il 55.6% di tutti i tumori del sangue. Complessivamente, in Italia costituiscono il 5,3% di tutti i tumori maligni (esclusi i tumori della pelle basocellulari e squamosi) con una prevalenza in costante crescita ad un ritmo del 3% annui. Sul piano istopatologico rappresentano un vasto gruppo eterogeneo di patologie ematologiche il cui grado viene formulato sulla base di definiti criteri cito-morfologici e anatomo-patologici.
Sebbene l’uso combinato degli approcci standard possa dare buoni tassi di risposta, d’altra parte nei pazienti sottoposti alle cure convenzionali le recidive sono particolarmente frequenti; con effetti collaterali critici e sovente irreversibili, quali la mielosoppressione e l’elevata frequenza di infezioni opportunistiche e sterilità. Numerosi studi epidemiologici e dati preclinici da tempo riportano gli effetti antitumorali di molecole quali Melatonina, Retinoidi, Vitamina E, D3, C, Somatostatina e inibitori prolattinici nelle patologie neoplastiche. Tuttavia, non vi sono molte pubblicazioni sugli effetti combinati di tali sostanze in vivo. Riportiamo di seguito uno studio osservazionale condotto su 55 pazienti affetti da forme varie di Linfoma, curati con la terapia biologica (Metodo DI Bella, DBM).
Sono state valutate le sopravvivenze osservate a 1, 3, 5 anni ed eventuali fenomeni di tossicità.
La terapia biologica MDB ha conseguito risposte obiettive parziali o complete, in tempi più brevi e in percentuale maggiore se somministrata come terapia di prima linea. Il trattamento adiuvante ha incrementato i tempi di sopravvivenza, e migliorato la qualità della vita rispetto ai dati della letteratura nelle stesse varietà e stadi di linfomi. Nel complesso il trattamento è stato ben tollerato: con effetti avversi di basso grado e transitori. I pazienti hanno potuto continuare il trattamento a domicilio, svolgendo tranquillamente le proprie attività.
Background
I Linfomi maligni rappresentano il quinto tipo di tumore per frequenza nel mondo occidentale con una incidenza pari a circa 19-20 casi per 100.000 abitanti. La sopravvivenza relativa dei pazienti con Linfoma di Hodgkin (HL) è rispettivamente del 93 % a 1 anno, 87% a 3 anni, 84 % a 5 anni (Morton LM. Et al., 2006).
Per quanto concerne i Linfomi non Hodgkin le percentuali sono rispettivamente: 80% a 1 anno, 73% a 3 anni e 71% a 5 anni, con leggere variazione in funzione del sottotipo (Registro Ttaliano dei Tumori).
Nella sola Italia, sono stati stimati nuovi casi 70.130 nuovi casi per il solo 2012 con 18,940 decessi. (Luminari S. Et al., 2007).
Attualmente sono disponibili differenti trattamenti per i Linfomi, i cui obiettivi sono essenzialmente rappresentati da una remissione il più possibile duratuta. Alcuni trattamenti sono definiti standard e prevedono l’impiego di agenti alchilanti (polichemioterapia), corticosteroidi, analoghi delle purine; mentre altri sono attualmente in fase di studio clinico (es: anticorpi monoclonali). Sebbene la combinazione di queste molecole possa portare verso una risposta a volte anche lungo termine, d’altro canto sono frequenti sia le recidive che la grave tossicità, come la mielosopressione, il rischio di infezioni, fino all’inevitabile coinvolgiento delle cellule staminali a seguito di trapianto autologo e successivo impiego della profilassi antibiotica, antivirale ed antimicotica.
Tali condizioni sono altamente invalidanti, a scapito della qualità della vita e della percentuale di remissione (Danilenko & Shakhmarina 2012; Gafter-Gvili et al. 2012; Schmitz et al. 2012; Zyrina, 2012; Farha et al. 2011; Atra et al. 1998).
Numerosi studi epidemiologici e dati preclinici da tempo riportano gli effetti antitumorali di molecole biologiche quali Melatonina (MLT), Retinoidi, Vitamina E, D3, C, Somatostatina (SST) e inibitori prolattinici nelle patologie neoplastiche. Tuttavia, non vi sono molte informazioni circa gli effetti combinati di tali sostanze in vivo.
Lo scopo del seguente studio è quello di investigare l’efficacia e la sicurezza della terapia biologica (Metodo Di Bella MDB) attraverso la combinazione di Somatostatina, Bromocriptina, Retinoidi, Melatonina, ACTH e blande dosi di Ciclofomamine su 55 pazienti affetti da Linfoma.
Arruolamento dei Pazienti e Metodi di analisi.
Nel presente studio sono stati arruolati 55 pazienti affetti da disordini linfoproliferativi.
Di questi, trentasei pazienti (47%) presentavano forme di linfoma recidivante e/o refrattario.
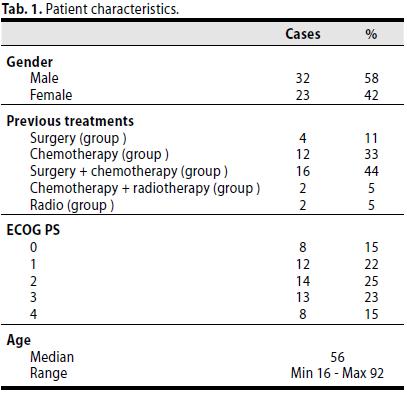
Trentadue casi di sesso mashile (58 %) e ventitre di sesso femminile (42 %).
La mediana dell’età era di 57 anni (min 19; max 95).
Dodici pazienti (22 %) sono affetti da Linfoma di Hodgkin mentre quarantatrè casi da Linfoma non Hodgkin (78%).
I Linfomi sono la principale forma di neoplasia ematologica: da sole rappresentano il 55.6% di tutti i tumori del sangue. Complessivamente, in Italia costituiscono il 5,3% di tutti i tumori maligni (esclusi i tumori della pelle basocellulari e squamosi) con una prevalenza in costante crescita ad un ritmo del 3% annui. Sul piano istopatologico rappresentano un vasto gruppo eterogeneo di patologie ematologiche il cui grado viene formulato sulla base di definiti criteri cito-morfologici e anatomo-patologici.
Sebbene l’uso combinato degli approcci standard possa dare buoni tassi di risposta, d’altra parte nei pazienti sottoposti alle cure convenzionali le recidive sono particolarmente frequenti; con effetti collaterali critici e sovente irreversibili, quali la mielosoppressione e l’elevata frequenza di infezioni opportunistiche e sterilità. Numerosi studi epidemiologici e dati preclinici da tempo riportano gli effetti antitumorali di molecole quali Melatonina, Retinoidi, Vitamina E, D3, C, Somatostatina e inibitori prolattinici nelle patologie neoplastiche. Tuttavia, non vi sono molte pubblicazioni sugli effetti combinati di tali sostanze in vivo. Riportiamo di seguito uno studio osservazionale condotto su 55 pazienti affetti da forme varie di Linfoma, curati con la terapia biologica (Metodo DI Bella, DBM).
Sono state valutate le sopravvivenze osservate a 1, 3, 5 anni ed eventuali fenomeni di tossicità.
La terapia biologica MDB ha conseguito risposte obiettive parziali o complete, in tempi più brevi e in percentuale maggiore se somministrata come terapia di prima linea. Il trattamento adiuvante ha incrementato i tempi di sopravvivenza, e migliorato la qualità della vita rispetto ai dati della letteratura nelle stesse varietà e stadi di linfomi. Nel complesso il trattamento è stato ben tollerato: con effetti avversi di basso grado e transitori. I pazienti hanno potuto continuare il trattamento a domicilio, svolgendo tranquillamente le proprie attività.
Background
I Linfomi maligni rappresentano il quinto tipo di tumore per frequenza nel mondo occidentale con una incidenza pari a circa 19-20 casi per 100.000 abitanti. La sopravvivenza relativa dei pazienti con Linfoma di Hodgkin (HL) è rispettivamente del 93 % a 1 anno, 87% a 3 anni, 84 % a 5 anni (Morton LM. Et al., 2006).
Per quanto concerne i Linfomi non Hodgkin le percentuali sono rispettivamente: 80% a 1 anno, 73% a 3 anni e 71% a 5 anni, con leggere variazione in funzione del sottotipo (Registro Ttaliano dei Tumori).
Nella sola Italia, sono stati stimati nuovi casi 70.130 nuovi casi per il solo 2012 con 18,940 decessi. (Luminari S. Et al., 2007).
Attualmente sono disponibili differenti trattamenti per i Linfomi, i cui obiettivi sono essenzialmente rappresentati da una remissione il più possibile duratuta. Alcuni trattamenti sono definiti standard e prevedono l’impiego di agenti alchilanti (polichemioterapia), corticosteroidi, analoghi delle purine; mentre altri sono attualmente in fase di studio clinico (es: anticorpi monoclonali). Sebbene la combinazione di queste molecole possa portare verso una risposta a volte anche lungo termine, d’altro canto sono frequenti sia le recidive che la grave tossicità, come la mielosopressione, il rischio di infezioni, fino all’inevitabile coinvolgiento delle cellule staminali a seguito di trapianto autologo e successivo impiego della profilassi antibiotica, antivirale ed antimicotica.
Tali condizioni sono altamente invalidanti, a scapito della qualità della vita e della percentuale di remissione (Danilenko & Shakhmarina 2012; Gafter-Gvili et al. 2012; Schmitz et al. 2012; Zyrina, 2012; Farha et al. 2011; Atra et al. 1998).
Numerosi studi epidemiologici e dati preclinici da tempo riportano gli effetti antitumorali di molecole biologiche quali Melatonina (MLT), Retinoidi, Vitamina E, D3, C, Somatostatina (SST) e inibitori prolattinici nelle patologie neoplastiche. Tuttavia, non vi sono molte informazioni circa gli effetti combinati di tali sostanze in vivo.
Lo scopo del seguente studio è quello di investigare l’efficacia e la sicurezza della terapia biologica (Metodo Di Bella MDB) attraverso la combinazione di Somatostatina, Bromocriptina, Retinoidi, Melatonina, ACTH e blande dosi di Ciclofomamine su 55 pazienti affetti da Linfoma.
Arruolamento dei Pazienti e Metodi di analisi.
Nel presente studio sono stati arruolati 55 pazienti affetti da disordini linfoproliferativi.
Di questi, trentasei pazienti (47%) presentavano forme di linfoma recidivante e/o refrattario.
Trentadue casi di sesso mashile (58 %) e ventitre di sesso femminile (42 %).
La mediana dell’età era di 57 anni (min 19; max 95).
Dodici pazienti (22 %) sono affetti da Linfoma di Hodgkin mentre quarantatrè casi da Linfoma non Hodgkin (78%).
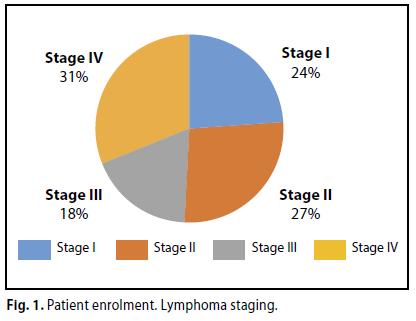
La stadiazione dei pazienti al momento dell’arruolamento è risultata la seguente:
Stadio I - 13 casi (24%),
Stadio II- 15 casi (27%),
Stadio III- 10 casi (18%),
stadio IV-17 casi (31%) (Tab. 1).
Stadio I - 13 casi (24%),
Stadio II- 15 casi (27%),
Stadio III- 10 casi (18%),
stadio IV-17 casi (31%) (Tab. 1).
La forme più rappresentative dei casi di LNH sono il sottotipo follicolare (13 casi= 30%), 15 casi (35%) erano a grandi cellule B (DLBCL); 5 (12%) casi Burkitt.
Nei casi di Linfoma di Hodgkin 8 casi (25%) erano di varietà classica scleronodulare.
La localizzazione delle lesioni è stata la seguente: estremità superiori (15.53 %), estremità inferiori (8.62 %), testa e collo (17.24 %), toracica (17.24 %), retroperitoneale (6.8 %), uterina (3.44 %), addominale (20.7 %) e regione pelvica (10.34 %).
I principali criteri di eleggibilità sono rappresentati da una diagnosi istologica o citologica di malattia neoplastica; dalla presenza di una malattia misurabile e/o valutabile; nel’aver sospeso la terapia antiblastica almeno quattro settimane prima dell’inizio del trattamento MDB; non avere ricevuto precedenti trattamenti MDB.
In aggiunta, sono esclusi dallo studio solo i pazienti nei quali sia stata verificata una delle seguenti violazioni di eleggibilità:
Nei casi di Linfoma di Hodgkin 8 casi (25%) erano di varietà classica scleronodulare.
La localizzazione delle lesioni è stata la seguente: estremità superiori (15.53 %), estremità inferiori (8.62 %), testa e collo (17.24 %), toracica (17.24 %), retroperitoneale (6.8 %), uterina (3.44 %), addominale (20.7 %) e regione pelvica (10.34 %).
I principali criteri di eleggibilità sono rappresentati da una diagnosi istologica o citologica di malattia neoplastica; dalla presenza di una malattia misurabile e/o valutabile; nel’aver sospeso la terapia antiblastica almeno quattro settimane prima dell’inizio del trattamento MDB; non avere ricevuto precedenti trattamenti MDB.
In aggiunta, sono esclusi dallo studio solo i pazienti nei quali sia stata verificata una delle seguenti violazioni di eleggibilità:
- pazienti che non hanno fornito il consenso informato scritto; pazienti per i quali non esisteva una conferma isto-citologica della specifica malattia neoplastica;
- pazienti che hanno iniziato il trattamento sperimentale prima della registrazione;
- pazienti che hanno effettuato la valutazione basale dopo l’inizio del trattamento;
- pazienti che dopo la registrazione non hanno iniziato il trattamento sperimentale. Tale categoria è stata monitorata unicamente per una valutazione della tossicità del trattamento.
Sono tuttavia stati inclusi i pazienti che in progressione o deceduti prima della rivalutazione.
I pazienti risultati idonei all’ arruolamento sono stati suddivisi nei seguenti gruppi:
I pazienti risultati idonei all’ arruolamento sono stati suddivisi nei seguenti gruppi:
Gruppo A (19 casi, 35 %): Pazienti i quali hanno usufruito del Trattamento Biologico- MDB come terapia di prima linea;
Gruppo B (36 casi, 65%): pazienti in progressione che hanno iniziato il MDB dopo interventi, chemio e/o radioterapia (trattamenti pregressi + MDB);
Gruppo B (36 casi, 65%): pazienti in progressione che hanno iniziato il MDB dopo interventi, chemio e/o radioterapia (trattamenti pregressi + MDB);
Di questi, i sottogruppi
B1: 12 casi (33 %), solo chemioterapia;
B2: 4 casi (11 %), solo intervento chirurgico;
B3: 2casi (5%), solo chemioterapia + radioterapia,
B4: 16 casi (44%) intervento chirurgico + chemioterapia;
B5: 2 casi (5%) solo radioterapia;
B2: 4 casi (11 %), solo intervento chirurgico;
B3: 2casi (5%), solo chemioterapia + radioterapia,
B4: 16 casi (44%) intervento chirurgico + chemioterapia;
B5: 2 casi (5%) solo radioterapia;
Raccolta dati
Per ciascun paziente arruolato nello studio è stata sviluppata una particolare scheda contenente informazioni cliniche. Tali schede sono state suddivise nelle seguenti sezioni:
- Prima sezione: valutazione basale; compilata al momento dell’arruolamento del paziente. Tale sezione riporta lo stadio della malattia, i siti della lesione (stadiazione), i parametri ematologici e i specifici marker tumorali;
- Seconda sezione: valutazione periodica; riguardante la rivalutazione dei siti delle lesioni e dei parametri ematochimici (ristadiazione), nonchè informazioni su eventuali effetti avversi/indesiderati del trattamento;
- Terza sezione: condizioni cliniche del paziente sino al termine dello studio (follow-up)
Protocollo terapeutico
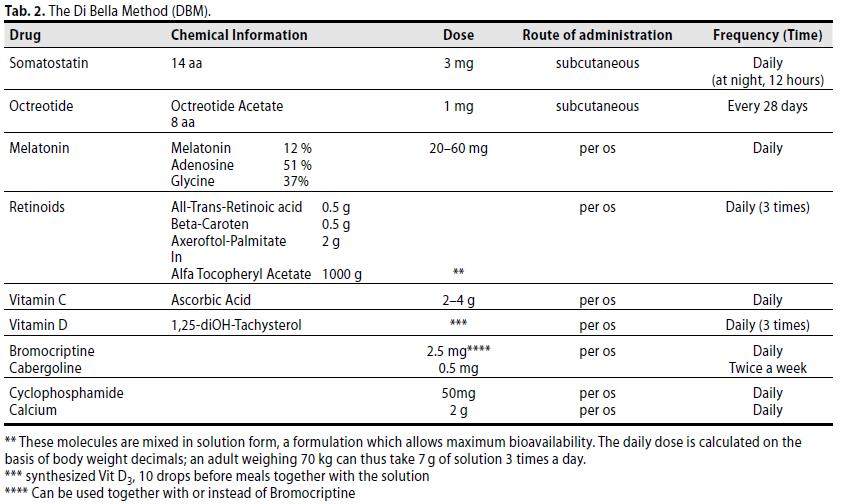
Tutti i pazienti hanno rievuto giornalmente una combinazione di somatostatina più retinoidi, melatonina, vitamina C, Vit. D, Bromocriptina e basse dosi di Ciclofosfamide.
Le rispettive dosi/modalità di somministrazione sono riportate di seguito (Tabella 2).
Valutazione della attività Anti-tumorale
Tale parametro è stato espresso in proporzione delle Risposte obiettive parziali e complete, definite socondo i canoni della Organizzazione Mondiale della Sanità (OMS) (Patrick Therasse et. Al, 1999).
La valutazione clinica è stata effettuata durante i periodi di ristadiazione della malattia. Sulla base dei criteri adottati per la valutazione della risposta in caso di risposta completa e/o parziale, è stato necessario confermare definitivamente dopo i 4 mesi di trattamento MDB.
Per l’attività antitumorale della suddetta terapia, tutti i pazienti sono stati classificati durante il periodo di rivalutazione, in funzione dei seguenti esiti: risposta completa/parziale dopo 4 mesi, progressione di malattia, stabilità, morte, sospensione volontaria, interruzione per possibile tossicità.
Per l’analisi di sopravvivenza è stato svolto un follow-up.
Per la valutazione dei dati clinici, sono stati presi come paramentri di indagine la sopravvivenza totale OS (Overall Survival) e le sopravvivenze osservate a 1, 3, 5 anni. E’ stata sviluppata altresì una curva di sopravvivenza (intentt-to-treat, ITT) dal momento dell’arruolamento fino al completamento della indagine (60 mesi). Da questa sono state estrapolate sia la Sopravvivenza Libera da Progressione (PFS) che la Sopravvivenza globale (OS).
Valutazione della tossicità
Ciascuno effetto indesiderato è stato valutato in funzione del grado di correlazione con il trattamento biologico, in accordo con i criteri standard (plausibilità dell’intervallo temporale tra la somministrazione del farmaco e ed il manifestarsi degli effetti avversi; presenza di eventuali cause alternative, ben noti effetti avversi correlati ad uno/più sostanze, attenuazione e/o perdita della reazione avversa a seguito della riduzione/sospensione della sostanza; ricomparsa dell’effetto avverso a seguito della risomministrazione del farmaco; e sulla base delle osservazioni degli operatori sanitari.
Durante lo studio sono stati considerati soltanto gli effetti avversi che, riguardo la tossicità, potevano essere correlati con il trattamento sperimentale (gradi di correlazione: possibile, probabile, certo) (Oken, M.M et al., 1982).
Risultati:
interpretazione statistica dei dati È stato condotta una indagine epidemiologica (studio pilota) su 55 pazienti affetti da Linfomi; la maggior parte recidivati o refrattari, per un periodo di 5 anni.
I dati raccolti sono stati sottoposti ad elaborazione statistica, ed è stata altresì ottenuta una «curva di sopravvivenza» intent to treat- ITT, riportando in ascissa il tempo di inizio trattamento ed in ordinata la percentuale di sopravvivenza (v. grafico).
L’end-point primario era la percentuale di risposta oggettiva (ORR) come da revisione indipendente. Gli endpoint secondari erano il tasso di remissione completa (RC), la durata della risposta, la sopravvivenza libera da progressione (PFS), la sopravvivenza globale (OS) e la sicurezza e tollerabilità.
Nel momento dell’analisi di follow-up a lungo termine, i dati mostrano le seguenti osservazioni:
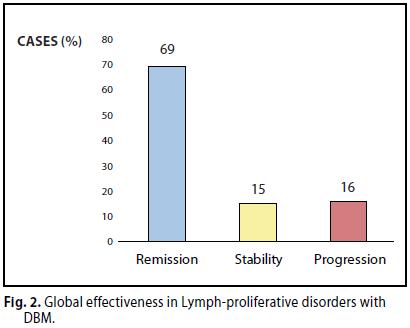
6 Complessivamente è stata osservata una risposta completa (CR) e stabile (SD) su 38 + 8 casi (84%).
Nove (9) casi (16 %) in progressione (P) (Figura 2).
Tale parametro è stato espresso in proporzione delle Risposte obiettive parziali e complete, definite socondo i canoni della Organizzazione Mondiale della Sanità (OMS) (Patrick Therasse et. Al, 1999).
La valutazione clinica è stata effettuata durante i periodi di ristadiazione della malattia. Sulla base dei criteri adottati per la valutazione della risposta in caso di risposta completa e/o parziale, è stato necessario confermare definitivamente dopo i 4 mesi di trattamento MDB.
Per l’attività antitumorale della suddetta terapia, tutti i pazienti sono stati classificati durante il periodo di rivalutazione, in funzione dei seguenti esiti: risposta completa/parziale dopo 4 mesi, progressione di malattia, stabilità, morte, sospensione volontaria, interruzione per possibile tossicità.
Per l’analisi di sopravvivenza è stato svolto un follow-up.
Per la valutazione dei dati clinici, sono stati presi come paramentri di indagine la sopravvivenza totale OS (Overall Survival) e le sopravvivenze osservate a 1, 3, 5 anni. E’ stata sviluppata altresì una curva di sopravvivenza (intentt-to-treat, ITT) dal momento dell’arruolamento fino al completamento della indagine (60 mesi). Da questa sono state estrapolate sia la Sopravvivenza Libera da Progressione (PFS) che la Sopravvivenza globale (OS).
Valutazione della tossicità
Ciascuno effetto indesiderato è stato valutato in funzione del grado di correlazione con il trattamento biologico, in accordo con i criteri standard (plausibilità dell’intervallo temporale tra la somministrazione del farmaco e ed il manifestarsi degli effetti avversi; presenza di eventuali cause alternative, ben noti effetti avversi correlati ad uno/più sostanze, attenuazione e/o perdita della reazione avversa a seguito della riduzione/sospensione della sostanza; ricomparsa dell’effetto avverso a seguito della risomministrazione del farmaco; e sulla base delle osservazioni degli operatori sanitari.
Durante lo studio sono stati considerati soltanto gli effetti avversi che, riguardo la tossicità, potevano essere correlati con il trattamento sperimentale (gradi di correlazione: possibile, probabile, certo) (Oken, M.M et al., 1982).
Risultati:
interpretazione statistica dei dati È stato condotta una indagine epidemiologica (studio pilota) su 55 pazienti affetti da Linfomi; la maggior parte recidivati o refrattari, per un periodo di 5 anni.
I dati raccolti sono stati sottoposti ad elaborazione statistica, ed è stata altresì ottenuta una «curva di sopravvivenza» intent to treat- ITT, riportando in ascissa il tempo di inizio trattamento ed in ordinata la percentuale di sopravvivenza (v. grafico).
L’end-point primario era la percentuale di risposta oggettiva (ORR) come da revisione indipendente. Gli endpoint secondari erano il tasso di remissione completa (RC), la durata della risposta, la sopravvivenza libera da progressione (PFS), la sopravvivenza globale (OS) e la sicurezza e tollerabilità.
Nel momento dell’analisi di follow-up a lungo termine, i dati mostrano le seguenti osservazioni:
6 Complessivamente è stata osservata una risposta completa (CR) e stabile (SD) su 38 + 8 casi (84%).
Nove (9) casi (16 %) in progressione (P) (Figura 2).
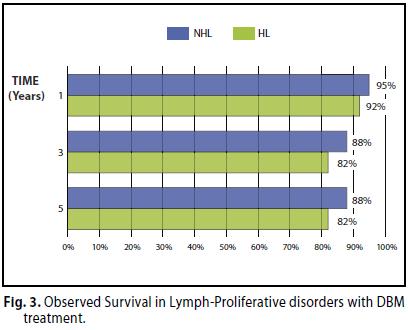
Per i pazienti affetti da LH la sopravvivenza complessiva osservata a 1, 3 e 5 anni è stata del 92%, 82% e 82% rispettivamente; mentre per i LNH del 95%, 88% ,88% rispettivamete (Figura 3).
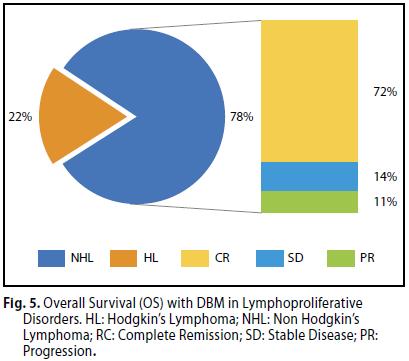
Sono stati osservati 72 % dei casi di risposta completa, 14 % di stabilità e 11 % in progressione. (figura 5)
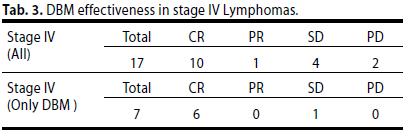
Dei 17 pazienti in stadio avanzato (stadio IV) 17 hanno ottenuto una risposta completa e continuano tutt’ora il trattamento.
Di questi, 7 hanno effettuato esclusivamente la terapia biologia come trattamento di prima linea. (Tabella 3).
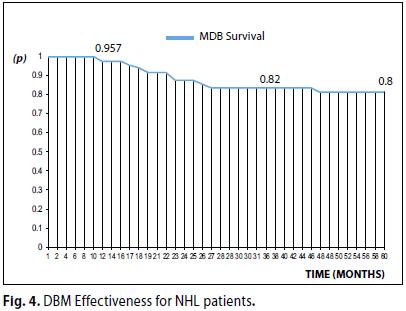
Dalla curva di sopravvivenza (Intent To Treat) (Figura 4) si può osservare che:
(a) a 12 mesi dal trattamento biologico è sopravvissuto ca il 96 % dei pazienti;
(b) a 36 mesi post-trattamento è sopravvissuto ca l’82 %;
(c) al termine della indagine epidemiologica (60 mesi), la Sopravvivenza globale (OS) è stata ca l’80%
(d) l'andamento della curva dimostra che una quota rilevante delle morti si verifica nei primi tre anni post trattamento.
Inoltre non è stata osservata alcuna ricorrenza di malattia con l’impiego del MDB come terapia adiuvante.
Performance Status:
E’ stato riscontrato un notevole miglioramento dei sintomi generali, maggiormente marcati nei pazienti che non hanno ricevuto trattamenti pregressi (chemio, radio, corticosteroidi). Ciò ha permesso la prosecuzione del trattamento a domicilio, svolgendo tranquillamente le proprie attività.
Effetti collaterali:
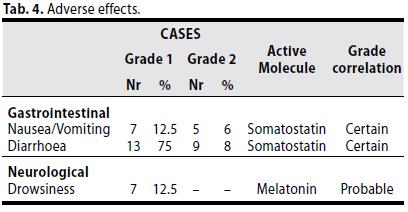
Gli effetti indesiderati al trattamento sono stati blandi e transitori (gradi 1-2)
La maggiorparte erano rappresentati da sintomi generali, quali disturbi di natura gastrointestinale (diarrea, nausea) e sonnolenza di basso grado, imputabili verosimilmente alla somministrazione della somatostatina e della melatonina rispettivamente. Tali effetti si sono mostrati transitori, con l’adattamento e la successiva scomparsa dopo ca 6 mesi (min 4, max 12) di trattamento.(Tabella 4).
Non è stato rilevato alcun decesso correlato al trattamento farmacologio.
E’ stato riscontrato un notevole miglioramento dei sintomi generali, maggiormente marcati nei pazienti che non hanno ricevuto trattamenti pregressi (chemio, radio, corticosteroidi). Ciò ha permesso la prosecuzione del trattamento a domicilio, svolgendo tranquillamente le proprie attività.
Effetti collaterali:
Gli effetti indesiderati al trattamento sono stati blandi e transitori (gradi 1-2)
La maggiorparte erano rappresentati da sintomi generali, quali disturbi di natura gastrointestinale (diarrea, nausea) e sonnolenza di basso grado, imputabili verosimilmente alla somministrazione della somatostatina e della melatonina rispettivamente. Tali effetti si sono mostrati transitori, con l’adattamento e la successiva scomparsa dopo ca 6 mesi (min 4, max 12) di trattamento.(Tabella 4).
Non è stato rilevato alcun decesso correlato al trattamento farmacologio.
Discussione
Molecole come la Somatostatina (SST), Prolattina (PRL), Retinoidi, Melatonina, (MLT) sono capaci di influenzare la crescrita linfoide(Sharma & Vinayak 2013; Sharma & Vinayak 2012; Paternoster et al. 2009; Bao et al. 2006; Bruemmer et al. 2003; Ashfaq et al. 2000; Brown et al. 1997; O’Neal et al. 1991; Persengiev & Kyurkchiev 1993; Abb & Deinhardt 1981), mentre l’impiego della ciclofosfamine nei disordini linfoproliferativi è ben noto in campo ematologico.
L’espressione recettoriale ubiquitaria della PRL e dell’ormone della crescita (Growth Hormone, GH) rappresenta uno degli aspetti del ruolo mitogeno, diretto e generalizzato, di queste molecole. E’ noto, e ampiamente documentato, il potente ruolo mitogeno del GH, della Prolattina; la coespressione, interattività e dimerizzazione delle rispettive proteine recettoriali di membrana (Matera L et al; 2000; Pellegrini I et al. 1992), il fatto che l’indice proliferativo e la velocità di progressione delle popolazioni neoplastiche risulti direttamente proporzionale all’espressione recettoriale del GH stesso.
La proliferazione cellulare dunque è strettamente dipendente dalla Prolattina (Singh et al. 2006; Rillema et al. 1992; Russell & Laird 1989; Buckley et al. 1988; Davis & Linzer 1988; Gout et al. 1980), e dal GH (Hooghe R et al., 1998), massimo fattore di crescita e da molecole mitogene GH dipendenti, da esso positivamente regolate, come il Fattore di Crescita Epidermico (EGF), il fattore di Crescita dei Fibroblasti (FGF), il Fattore di Crescita degli Epatociti (HGF), il Fattore di Crescita simile all’Insulina (IGF), il Fattore di Crescita Neuronale (NGF), il Fattore di Crescita di Derivazione Piastrinica (PDGF), il Fattore di Crescita Trasformante (TGF), il Fattore di Crescita Endoteliale Vascolare (VEGF); oltre che da fattori di crescita prodotti dall’apparato gastrointestinale, come il Peptide Intestinale Vaoattivo (VIP), la Colecistochinna (CCK) e la Gastrina (G).(Matt et al. 2009; Trejo et al. 2004; Ferrara & Gerber 2002; Ornitz & Itoh 2001; Boonstra et al. 1995; Cos & Blask 1994; Comoglio, 1993; Lüscher et al. 1992; Heldin & Westermark 1991).
Sia la proliferazione cellulare fisiologica che quella neoplastica avvengono per mezzo di queste stesse molecole, che la cellula neoplastica utilizza, però, in rapporto esponenziale rispetto a quella sana [ref]. La perdita di differenziazione e la proliferazione incontrollata, anche se in misura diversa, caratterizzano tutte le neoplasie (Ruscica et al. 2012; Tejeda et al. 2008).
L’impiego della somatostatina e analoghi, agendo sulla crescita, denominatore comune a ogni tumore, può trovare indicazione razionale in ogni neoplasia (Ruscica M. et al., 2012; Tejeda M. et al., 2008) In molti tumori, non solo in quelli neuroendocrini, è stata documentata un’espressione recettoriale per la somatostatina (Hasskarl et al. 2011; Ferone et al. 2011; Keller et al. 2005; Dalm et al. 2004; Zhou et al. 2002; Oomen et al. 2000; Van den Anker-Lugtenburg et al. 1996; Lipp et al. 1995; Witzig et al. 1995; Reubi et al. 1992; Baschieri et al. 1989; Jakobs & Schultz 1983).
E’ infatti dimostrato anche il rapporto causale e proporzionale tra espressione recettoriale del GH (di cui la SST è l’antitodo biologico) e induzione e progressione tumorale rilevando sia mediante tecniche di Biologia Molecolare (PCR, Western Blot), che istochimiche, concentrazioni del recettore dell’Ormone della crescita (GHR) nettamente superiori nei tessuti tumorali rispetto a quelli sani (Lin et al. 2011; Gebre-Medhin et al. 2001).
E’ ormai assodato che la progressione neoplastica è strettamente dipendente dall’angiogenesi e lymphangiogenesi, e che ne rappresentano una fase obbligata ed essenziale (Aggarwal et al. 2012; Bergers & Benjamin 2003; Greenblatt & Shubi 1968).
L’acquisizione di un fenotipo angiogenico è decisivo per l’espansione del tumore. Somatostatina e analoghi regolano negativamente gli “induttori angiogenici” e tutte le fasi dell’angiogenesi come la cascata dei monociti l’interleukina 8 (IL-8), la Prostaglandina E 2 (PGE2) e il VIP, l’Ossido-Nitrico-Sintasi endoteliale (e-Nos) (Ribatti D., 2007; Dasgupta P, 2004; Arena Set al., 2004; Florio T et al., 2003; García de la Torre, 2002) oltre ai fattori di crescita il cui sinergismo è essenziale per l’angiogenesi stessa, come il VEGF-A TGF, FGF, HGF PDGF (Chekhonin VP et al, 2012; Woltering EA, 2003).
L’inibizione dell’angiogenesi indotta dalla SST è sinergicamente e fattorialmente potenziata dagli altri componenti del MDB, quali MLT, Retinoidi, Vitamina D3, Vitamina C, inibitori prolattinici (agonisti Dopaminergici) e componenti della matrice extracellulare come la Galattosamina Solfato. Ugualmente l’effetto citostatico, antiproliferativo, antimetastatico della Somatostatina è efficacemente sinergizzato dagli inibitori prolattinici (Cabergolina e Bromocriptina) e dagli altri componenti del MDB come Retinoidi, MLT, Vitamina D3 Calcio Vit E, Vit C. (Fujita et al. 2010; Singh et al. 2010; Trump et al. 2006; Trubiani et al. 2005; Chen et al. 2005; Guidoboni et al. 2005; Consolini et al. 2001; Dalen & Neuzil 2003; Darwiche et al. 2001; Lissoni et al. 2000; Sarna et al. 2000; Bode et al. 1999; Sundaresan et al. 1997; Yu et al. 1996,1997; Turley et al. 1995; Defacque et al. 1994; Drake et al. 2010; Hickish et al. 1993; Kao et al. 1993; Thomas & Hoffman 1989; Haverty et al. 1987).
Queste evidenze scientifiche hanno fornito il razionale per condurre, in pazienti affetti da differenti forme di Linfoma, uno studio pilota sul loro uso combinato. I risultati della indagine hanno permesso di confermare non solo la già nota attività anti-tumorale di retinoidi (Kempf W et al., 2003; Younes A, et al., 2000; Knobler RM et al., 1991 ), e vitamine D3, E nelle suddette patologie linfoproliferative (Nieto-Rementería N et al., 2009; Zhang C. Et al., 9 2002; Drake MT et al. 2001), ma alresì di riscontrare una spiccata risposta in termini di qualità della vita e totale assenza dei rilevanti effetti avversi, sovente debilitanti, che si manifestano spesso nei consueti trattamenti oncologici.
I fenomeni quali Leucopenia (Schmitz et al., 2012) , Piastrinopenia, ed immunosopressione, attribuiti alla somministrazione di dosi massiccie di chemioterapici; sono lievi e spesso assenti con l’uso concomitante di basse dosi (50mg) di ciclofosfamide e molecole a spiccata attività trofica e mieloprotettiva, quali MLT e Vitamine (Anwar et al. 1998; Heaney et al. 2008; Sarna & Bhola 1993; Prasad et al. 1992; Coleman et al. 2012; Prasad et al. 2010).
Tale combinazione favorisce il viraggio del meccanismo d’azione della molecola alchilante, ottenendo dei vantaggi sia in termini farmacologici che di PS.
Conclusioni
Il suddetto approccio biologico (MDB) pone come obiettivo càrdine la salvaguardia e il ripristino del terreno biologico (microambiente). L'azione di ripristino (omeostasi) si ottiene attraverso un' attività bifasica, potenziando da una parte la crescita cellulare ordinata e fisiologica (differenziata) dei tessuti sani in contrapposizione a quella incontrollata e afinalistica (indifferenziata) di quelli neoplastici. A queste azioni vanno aggiunte l' attività antiossidante, antiradicali liberi, prodifferenziante (riconversione alla normalità cellule tumorali o indifferenziate), proapoptotica (inducono la cellula neoplastica alla morte cellulare, con meccanismi fisiologici, non citotossici), immunostimolante (Melatonina e Vitamine), antiproliferativa (Melatonina, Somatostatina,inibitori prolattinici, Vitamine), antimetastatica e con modalità e meccanismi sia diretti che indiretti, di potenziamento dell' inibizione dei fattori di crescita (Di Bella G. et Al., 2010)
Molecole come la Somatostatina (SST), Prolattina (PRL), Retinoidi, Melatonina, (MLT) sono capaci di influenzare la crescrita linfoide(Sharma & Vinayak 2013; Sharma & Vinayak 2012; Paternoster et al. 2009; Bao et al. 2006; Bruemmer et al. 2003; Ashfaq et al. 2000; Brown et al. 1997; O’Neal et al. 1991; Persengiev & Kyurkchiev 1993; Abb & Deinhardt 1981), mentre l’impiego della ciclofosfamine nei disordini linfoproliferativi è ben noto in campo ematologico.
L’espressione recettoriale ubiquitaria della PRL e dell’ormone della crescita (Growth Hormone, GH) rappresenta uno degli aspetti del ruolo mitogeno, diretto e generalizzato, di queste molecole. E’ noto, e ampiamente documentato, il potente ruolo mitogeno del GH, della Prolattina; la coespressione, interattività e dimerizzazione delle rispettive proteine recettoriali di membrana (Matera L et al; 2000; Pellegrini I et al. 1992), il fatto che l’indice proliferativo e la velocità di progressione delle popolazioni neoplastiche risulti direttamente proporzionale all’espressione recettoriale del GH stesso.
La proliferazione cellulare dunque è strettamente dipendente dalla Prolattina (Singh et al. 2006; Rillema et al. 1992; Russell & Laird 1989; Buckley et al. 1988; Davis & Linzer 1988; Gout et al. 1980), e dal GH (Hooghe R et al., 1998), massimo fattore di crescita e da molecole mitogene GH dipendenti, da esso positivamente regolate, come il Fattore di Crescita Epidermico (EGF), il fattore di Crescita dei Fibroblasti (FGF), il Fattore di Crescita degli Epatociti (HGF), il Fattore di Crescita simile all’Insulina (IGF), il Fattore di Crescita Neuronale (NGF), il Fattore di Crescita di Derivazione Piastrinica (PDGF), il Fattore di Crescita Trasformante (TGF), il Fattore di Crescita Endoteliale Vascolare (VEGF); oltre che da fattori di crescita prodotti dall’apparato gastrointestinale, come il Peptide Intestinale Vaoattivo (VIP), la Colecistochinna (CCK) e la Gastrina (G).(Matt et al. 2009; Trejo et al. 2004; Ferrara & Gerber 2002; Ornitz & Itoh 2001; Boonstra et al. 1995; Cos & Blask 1994; Comoglio, 1993; Lüscher et al. 1992; Heldin & Westermark 1991).
Sia la proliferazione cellulare fisiologica che quella neoplastica avvengono per mezzo di queste stesse molecole, che la cellula neoplastica utilizza, però, in rapporto esponenziale rispetto a quella sana [ref]. La perdita di differenziazione e la proliferazione incontrollata, anche se in misura diversa, caratterizzano tutte le neoplasie (Ruscica et al. 2012; Tejeda et al. 2008).
L’impiego della somatostatina e analoghi, agendo sulla crescita, denominatore comune a ogni tumore, può trovare indicazione razionale in ogni neoplasia (Ruscica M. et al., 2012; Tejeda M. et al., 2008) In molti tumori, non solo in quelli neuroendocrini, è stata documentata un’espressione recettoriale per la somatostatina (Hasskarl et al. 2011; Ferone et al. 2011; Keller et al. 2005; Dalm et al. 2004; Zhou et al. 2002; Oomen et al. 2000; Van den Anker-Lugtenburg et al. 1996; Lipp et al. 1995; Witzig et al. 1995; Reubi et al. 1992; Baschieri et al. 1989; Jakobs & Schultz 1983).
E’ infatti dimostrato anche il rapporto causale e proporzionale tra espressione recettoriale del GH (di cui la SST è l’antitodo biologico) e induzione e progressione tumorale rilevando sia mediante tecniche di Biologia Molecolare (PCR, Western Blot), che istochimiche, concentrazioni del recettore dell’Ormone della crescita (GHR) nettamente superiori nei tessuti tumorali rispetto a quelli sani (Lin et al. 2011; Gebre-Medhin et al. 2001).
E’ ormai assodato che la progressione neoplastica è strettamente dipendente dall’angiogenesi e lymphangiogenesi, e che ne rappresentano una fase obbligata ed essenziale (Aggarwal et al. 2012; Bergers & Benjamin 2003; Greenblatt & Shubi 1968).
L’acquisizione di un fenotipo angiogenico è decisivo per l’espansione del tumore. Somatostatina e analoghi regolano negativamente gli “induttori angiogenici” e tutte le fasi dell’angiogenesi come la cascata dei monociti l’interleukina 8 (IL-8), la Prostaglandina E 2 (PGE2) e il VIP, l’Ossido-Nitrico-Sintasi endoteliale (e-Nos) (Ribatti D., 2007; Dasgupta P, 2004; Arena Set al., 2004; Florio T et al., 2003; García de la Torre, 2002) oltre ai fattori di crescita il cui sinergismo è essenziale per l’angiogenesi stessa, come il VEGF-A TGF, FGF, HGF PDGF (Chekhonin VP et al, 2012; Woltering EA, 2003).
L’inibizione dell’angiogenesi indotta dalla SST è sinergicamente e fattorialmente potenziata dagli altri componenti del MDB, quali MLT, Retinoidi, Vitamina D3, Vitamina C, inibitori prolattinici (agonisti Dopaminergici) e componenti della matrice extracellulare come la Galattosamina Solfato. Ugualmente l’effetto citostatico, antiproliferativo, antimetastatico della Somatostatina è efficacemente sinergizzato dagli inibitori prolattinici (Cabergolina e Bromocriptina) e dagli altri componenti del MDB come Retinoidi, MLT, Vitamina D3 Calcio Vit E, Vit C. (Fujita et al. 2010; Singh et al. 2010; Trump et al. 2006; Trubiani et al. 2005; Chen et al. 2005; Guidoboni et al. 2005; Consolini et al. 2001; Dalen & Neuzil 2003; Darwiche et al. 2001; Lissoni et al. 2000; Sarna et al. 2000; Bode et al. 1999; Sundaresan et al. 1997; Yu et al. 1996,1997; Turley et al. 1995; Defacque et al. 1994; Drake et al. 2010; Hickish et al. 1993; Kao et al. 1993; Thomas & Hoffman 1989; Haverty et al. 1987).
Queste evidenze scientifiche hanno fornito il razionale per condurre, in pazienti affetti da differenti forme di Linfoma, uno studio pilota sul loro uso combinato. I risultati della indagine hanno permesso di confermare non solo la già nota attività anti-tumorale di retinoidi (Kempf W et al., 2003; Younes A, et al., 2000; Knobler RM et al., 1991 ), e vitamine D3, E nelle suddette patologie linfoproliferative (Nieto-Rementería N et al., 2009; Zhang C. Et al., 9 2002; Drake MT et al. 2001), ma alresì di riscontrare una spiccata risposta in termini di qualità della vita e totale assenza dei rilevanti effetti avversi, sovente debilitanti, che si manifestano spesso nei consueti trattamenti oncologici.
I fenomeni quali Leucopenia (Schmitz et al., 2012) , Piastrinopenia, ed immunosopressione, attribuiti alla somministrazione di dosi massiccie di chemioterapici; sono lievi e spesso assenti con l’uso concomitante di basse dosi (50mg) di ciclofosfamide e molecole a spiccata attività trofica e mieloprotettiva, quali MLT e Vitamine (Anwar et al. 1998; Heaney et al. 2008; Sarna & Bhola 1993; Prasad et al. 1992; Coleman et al. 2012; Prasad et al. 2010).
Tale combinazione favorisce il viraggio del meccanismo d’azione della molecola alchilante, ottenendo dei vantaggi sia in termini farmacologici che di PS.
Conclusioni
Il suddetto approccio biologico (MDB) pone come obiettivo càrdine la salvaguardia e il ripristino del terreno biologico (microambiente). L'azione di ripristino (omeostasi) si ottiene attraverso un' attività bifasica, potenziando da una parte la crescita cellulare ordinata e fisiologica (differenziata) dei tessuti sani in contrapposizione a quella incontrollata e afinalistica (indifferenziata) di quelli neoplastici. A queste azioni vanno aggiunte l' attività antiossidante, antiradicali liberi, prodifferenziante (riconversione alla normalità cellule tumorali o indifferenziate), proapoptotica (inducono la cellula neoplastica alla morte cellulare, con meccanismi fisiologici, non citotossici), immunostimolante (Melatonina e Vitamine), antiproliferativa (Melatonina, Somatostatina,inibitori prolattinici, Vitamine), antimetastatica e con modalità e meccanismi sia diretti che indiretti, di potenziamento dell' inibizione dei fattori di crescita (Di Bella G. et Al., 2010)
Bibliografia:
- Abb J & Deinhardt F (1981). Retinoid-induced growth inhibition of herpes virus-transformed marmoset lymphoblastoid cell lines. Oncology. 38(6): 346–50.
- Aggarwal D, Srivastava G, Gupta R, Pant L, Krishan G, Singh S (2012). Angiogenesis in Non Hodgkin’s Lymphoma: An Intercategory Comparison of Microvessel Density. ISRN Hematol. 2012:943089.
- Anwar MM, Mahfouz HA, Sayed AS (1998).Potential protective effects of melatonin on bone marrow of rats exposed to cytotoxic drugs. Comp Biochem Physiol A Mol Integr Physiol. 119(2):493–501.
- Ashfaq MK, Zuberi HS, Anwar Waqar M (2000). Vitamin E and beta-carotene affect natural killer cell function. Int J Food Sci Nutr. 51(Suppl): S13–20.
- Atra A, Gerrard M, Hobson R, Imeson JD, Ashley S, Pinkerton CR (1998). Improved cure rate in children with B-cell acute lymphoblastic leukaemia (B-ALL) and stage IV B-cell non-Hodgkin’s lymphoma (B-NHL)--results of the UKCCSG 9003 protocol. Br J Cancer. 77(12): 2281–2285.
- Arena S, Pattarozzi A, Corsaro A, Schettini G, Florio T (2005). Somatostatin receptor subtype-dependent regulation of nitric oxide release: involvement of different intracellular pathways. Mol Endocrinol. 19(1): 255–67.
- Bao GC, Wang JG, Jong A (2006). Increased p21 expression and complex formation with cyclin E/CDK2 in retinoid-induced pre-B lymphoma cell apoptosis. FEBS Lett. 580(15): 3687–93.
- Baschieri L, Castagna M, Fierabracci A, Antonelli A, Del Guerra P, Squartini F (1989). Distribution of calcitonin- and somatostatincontaining cells in thyroid lymphoma and in Hashimoto’s thyroiditis. Appl Pathol. 7(2): 99–104.
- Bergers G & Benjamin LE (2003). Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 3(6): 401–410.
- Bode AM, Liang HQ, Green EH, Meyer TE, Buckley DJ, Norris A, et al (1999). Ascorbic acid recycling in Nb2 lymphoma cells: implications for tumor progression. Free Radic Biol Med. 26 (1–2): 136–147.
- Boonstra J, Rijken P, Humbel B, Cremers F, Verkleij A, van Bergen en Henegouwen P (1995). The epidermal growth factor. Cell Biol Int. 19(5): 413–430.
- Brown TR, Stonehouse TJ, Branch JS, Brickell PM, Katy DR (1997). Stable transfection of U937 cells with sense or antisense RXRalpha cDNA suggests a role for RXR-alpha in the control of monoblastic differentiation induced by retinoic acid and vitamin D. Exp Cell Res. 236(1): 94–102.
- Bruemmer B, Patterson RE, Cheney C, Aker SN, Witherspoon RP (2003). The association between vitamin C and vitamin E supplement use before hematopoietic stem cell transplant and outcomes to two years. J Am Diet Assoc. 103(8): 982–90.
- Buckley AR, Putnam CW, Russell DH (1988). Prolactin as a mammalian mitogen and tumor promoter. Adv Enzyme Regul. 27: 371–391.
- Chekhonin VP, Shein SA, Korchagina AA, Gurina OI (2012). VEGF in tumor progression and targeted therapy. Curr Cancer Drug Targets. 2012 Nov 15. [Epub ahead of print].
- Chen Q, Espey MG, Krishna MC, Mitchell JB, Corpe CP, Buettner GR, et al (2005). Pharmacologic ascorbic acid concentrations selectively kill cancer cells: action as a pro-drug to deliver hydrogen peroxide to tissues. Proc Natl Acad Sci U S A. 102(38): 13604–13609.
- Coleman M, Ruan G, Elstrom RL, Martin P, Leonard JP (2012). Metronomic therapy for refractory/relapsed lymphoma: the PEP-C low-dose oral combination chemotherapy regimen. Hematology. 17(Suppl 1): S90–92.
- Comoglio PM (1993). Structure, biosynthesis and biochemical properties of the HGF receptor in normal and malignant cells. EXS. 65: 131–165.
- Consolini R, Pala S, Legitimo A, Crimaldi G, Ferrari S, Ferrari S (2001). Effects of vitamin D on the growth of normal and malignant B-cell progenitors. Clin Exp Immunol. 126(2): 214–219.
- Cos S & Blask DE (1994). Melatonin modulates growth factor activity in MCF-7 human breast cancer cells. J Pineal Res. 17(1): 25–32.
- Dalen H & Neuzil J (2003). Alpha-tocopheryl succinate sensitises a T lymphoma cell line to TRAIL-induced apoptosis by suppressing NF-kappaB activation. Br J Cancer. 88(1): 153–158.
- Dalm VA, Hofland LJ, Mooy CM, Waaijers MA, van Koetsveld PM, Langerak AW, et al (2004). Somatostatin receptors in malignant lymphomas: targets for radiotherapy? J Nucl Med. 45(1): 8–16.
- Danilenko AA & Shakhmarina SV (2012). [Problems in the preservation of reproductive function in female patients after treatment for Hodgkinlymphoma]. Vopr Onkol. 58(3): 320–6. Review. Russian.
- Dasgupta P (2004). Somatostatin analogues: multiple roles in cellular proliferation, neoplasia, and angiogenesis. Pharmacol Ther. 102(1): 61–85.
- Davis JA & Linzer DI (1988). Autocrine stimulation of Nb2 cell proliferation by secreted, but not intracellular, prolactin. Mol Endocrinol. 2(8): 740–746.
- Darwiche N, El-Sabban M, Bazzi R, Nasr R, Al-Hashimi S, Hermine O, et al (2001). Retinoic acid dramatically enhances the arsenic trioxide-induced cell cycle arrest and apoptosis in retinoic acid receptor alpha-positive human T-cell lymphotropic virus type-Itransformed cells. Hematol J. 2(2): 127–135.
- Defacque H, Commes T, Sevilla C, Rochete-Egly C, Marti J (1994). Synergistic differentiation of U937 cells by all-trans retinoic acid and 1 alpha, 25-dihydroxyvitamin D3 is associated with the expression of retinoid X receptor alpha. Biochem Biophys Res Commun. 203(1): 272–80.
- Di Bella G (2010). The Di Bella Method (DBM). Neuro Endocrinol Lett. 31(Suppl 1): 1–42.
- Drake MT, Maurer MJ, Link BK, Habermann TM, Ansell SM, Micallef IN, et al (2010). Vitamin D insufficiency and prognosis in non-Hodgkin’s lymphoma. J Clin Oncol. 28(27): 4191–2.
- Duvic M, Hymes K, Heald P, Breneman D, Martin AG, Myskowski P, et al (2001). Bexarotene is effective and safe for treatment of refractory advanced-stage cutaneous T-cell lymphoma: multinational phase II-III trial results. J Clin Oncol. 19(9): 2456–2471.
- Farha G, Nasr E, Ghosn M, Nasr DN, Nasr F, Kattan J, et al. (2011). [Chemoradiotherapy in early stage Hodgkin’s lymphoma]. [Article in French] J Med Liban. 59(3): 122–125.
- Ferone D, Pivonello R, Kwekkeboom DJ, Gatto F, Ameri P, Colao A, et al (2011). Immunohistochemical localization and quantitative expression of somatostatin receptors in normal human spleen and thymus: implications for the in vivo visualization during somatostatin receptor scintigraphy. J Endocrinol Invest. 35(5): 528–534.
- Ferrara N & Gerber HP (2002). The role of vascular endothelial growth factor in angiogenesis. Acta Haematol. 106(4): 148–156.
- Florio T, Morini M, Villa V, Arena S, Corsaro A, Thellung S, et al. (2003). Somatostatin inhibits tumor angiogenesis and growth via somatostatinreceptor-3-mediated regulation of endothelial nitric oxide synthase and mitogen-activated protein kinase activities. Endocrinology. 144(4): 1574–1584.
- Fujita H, Shiva D, Utsumi T, Ogino T, Ogawa T, Abe K, et al (2010). Alpha-tocopheryl succinate induces rapid and reversible phosphatidylserine externalization in histiocytic lymphoma through the caspase-independent pathway. Mol Cell Biochem. 333(1–2): 137–149.
- Gafter-Gvili A, Fraser A, Paul M, Vidal L, Lawrie TA, van de Wetering MD, et al. (2012). Antibiotic prophylaxis for bacterial infections in afebrile neutropenic patients following chemotherapy. Cochrane Database Syst Rev. 1:CD004386.
- García de la Torre N, Wass JA, Turner HE (2002). Antiangiogenic effects of somatostatin analogues. Clin Endocrinol (Oxf ). 57(4): 425–441.
- Gebre-Medhin M, Kindblom LG, Wennbo H, Tornell J, Meis- Kindblom JM (2001). Growth Hormone Receptor Is Expressed in Human Breast Cancer. Am J Pathol. 158(4): 1217–1222.
- Gout PW, Beer CT, Noble RL (1980). Prolactin-stimulated growth of cell cultures established from malignant Nb rat lymphomas. Cancer Res. 40(7): 2433–2436.
- Greenblatt M & Shubi P (1968). Tumor Angiogenesis: Trans filter diffusion studies by the transparent chamber technique. J Natl Cancer Inst. 41: 111–124.
- Guidoboni M, Zancai P, Cariati R, Rizzo S, Dal Col J, Pavan A, et al (2005). Retinoic acid inhibits the proliferative response induced by CD40 activation and interleukin-4 in mantle cell lymphoma. Cancer Res. 65(2): 587–595.
- Hasskarl J, Kaufmann M, Schmid HA (2011). Somatostatin receptors in non-neuroendocrine malignancies: the potential role of somatostatin analogs in solid tumors. Future Oncol. 7(7): 895–913.
- Haverty T, Haddad JG, Neilson EG (1987). 1,25-dihydroxyvitamin D3 stimulates interleukin-2 production by a T cell lymphoma line (MLA-144) cultured in vitamin D-deficient rat serum. J Leukoc Biol. 41(2): 177–182.
- Heaney ML, Gardner JR, Karasavvas N, Golde DW, Scheinberg DA, Smith EA, OConnor OA (2008). Vitamin C antagonizes the cytotoxic effects of antineoplastic drugs. Cancer Res. 68(19): 8031–8.
- Heldin CH & Westermark B (1991). Platelet-derived growth factor and autocrine mechanisms of oncogenic processes. Crit Rev Oncog. 2: 109–124.
- Hickish T, Cunningham D, Colston K, Millar BC, Sandle J, Mackay AG, et al (1993). The effect of 1,25-dihydroxyvitamin D3 on lymphoma cell lines and expression of vitamin D receptor in lymphoma. Br J Cancer. 68(4): 668–762.
- Hooghe R, Merchav S, Gaidano G, Naessens F, Matera L (1998). A role for growth hormone and prolactin in leukaemia and lymphoma? Cell Mol Life Sci. 54(10): 1095–101.
- Jakobs KH & Schultz G (1983). Occurrence of a hormone-sensitive inhibitory coupling component of the adenylate cyclase in S49 lymphoma cyc- variants. Proc Natl Acad Sci U S A. 80(13): 3899–902.
- Kao TL, Meyer WJ 3rd, Post JF (1993). Inhibitory effects of ascorbic acid on growth of leukemic and lymphoma cell lines. Cancer Lett. 70(1–2): 101–106.
- Keller G, Engel JB, Schally AV, Nagy A, Hammann B, Halmos G (2005). Growth inhibition of experimental non-Hodgkin’s lymphomas with the targeted cytotoxic somatostatin analogue AN-238. Int J Cancer. 114(5): 831–835.
- Kempf W, Kettelhack N, Duvic M, Burg G (2003). Topical and systemic retinoid therapy for cutaneous T-cell lymphoma. Hematol Oncol Clin North Am. 17(6): 1405–1419.
- Knobler RM, Trautinger F, Radaszkiewicz T, Kokoschka EM, Micksche M (1991). Treatment of cutaneous T cell lymphoma with a combination of low-dose interferon alfa-2b and retinoids. J Am Acad Dermatol. 24(2 Pt 1):247–252.
- Lipp RW, Silly H, Ranner G, Dobnig H, Passath A, Leb G, Krejs GJ (1995). Radiolabeled octreotide for the demonstration of somatostatin receptors in malignant lymphoma and lymphadenopathy. J Nucl Med. 36(1): 13–18.
- Luminari S, Cesaretti M, Rashid I, Mammi C, Montanini A, Barbolini E, et al (2007). Incidence, clinical characteristics and survival of malignant lymphomas: a population-based study from a cancer registry in northern Italy. Hematol Oncol. 25: 189–197.
- Lissoni P, Bolis S, Brivio F, Fumagalli L (2000). A phase II study of neuroimmunotherapy with subcutaneous low-dose IL-2 plus the pineal hormone melatonin in untreatable advanced hematologic malignancies. Anticancer Res. 20(3B): 2103–2105.
- Lin Y, Li S, Cao P, Cheng L, Quan M, Jiang S (2011). The effects of recombinant human GH on promoting tumor growth depend on the expression of GH receptor in vivo. J Endocrinol. 211(3):249–256.
- Lüscher TF, Boulanger CM, Dohi Y, Yang ZH (1992). Endotheliumderived contracting factors. Hypertension. 19(2): 117–130.
- Matera L, Geuna M, Pastore C, Buttiglieri S, Gaidano G, Savarino A, et al (2000). Expression of prolactin and prolactin receptors by non-Hodgkin’s lymphoma cells. Int J Cancer. 85(1): 124–130.
- Matt P, Schoenhoff F, Habashi J, Holm T, Van Erp C, Loch D, et al (2009). Circulating transforming growth factor-{beta} in Marfan syndrome. GenTAC Consortium. Circulation. 120(6): 526–532.
- Morton LM, Wang SS, Devesa SS, Hartge P, Weisenburger DD, Linet MS (2006). Lymphoma incidence patterns by WHO subtype in the United States, 1992–2001. Blood. 107: 265–276.
- Nieto-Rementería N, Perez-Yarza G, Boyano MD, Apraiz A, Izu R, Diaz-Perez JL, Asumendi A (2009). Bexarotene activates the p53/p73 pathway in human cutaneous T-cell lymphoma. Br J Dermatol. 160(3): 519–526.
- Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP (1982). Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol. 5:649–655.
- Oomen SP, Hofland LJ, van Hagen PM, Lamberts SW, Touw IP (2000). Somatostatin receptors in the haematopoietic system. Eur J Endocrinol. 143(Suppl 1): S9–14.
- O’Neal KD, Schwarz LA, Yu-Lee Ly (1991). Prolactin receptor gene expression in lymphoid cells. Mol Cell Endocrinol. 82(2–3): 127–135.
- Ornitz D &, Itoh N (2001). Fibroblast growth factors. Genome Biol. 2(3): 1–12.
- Paternoster L, Radogna F, Accorsi A, Cristina Albertini M, Gualandi G, Ghibelli L (2009). Melatonin as a modulator of apoptosis in B-lymphoma cells. Ann N Y Acad Sci. 1171: 345–349.
- Pellegrini I, Lebrun JJ, Ali S, Kelly PA (1992). Expression of prolactin and its receptor in human lymphoid cells. Mol Endocrinol. 6(7): 1023–1031.
- Persengiev SP & Kyurkchiev S (1993). Selective effect of melatonin on the proliferation of lymphoid cells. Int J Biochem. 25(3): 441–444.
- Prasad SB, Giri A, Arjun J (1992). Use of subtherapeutical dose of cisplatin and vitamin C against murine Dalton’s lymphoma. Pol J Pharmacol Pharm. 44(4): 383–391.
- Prasad SB, Rosangkima G, Nicol BM (2010). Cyclophosphamide and ascorbic acid-mediated ultrastructural and biochemical changes in Dalton’s lymphoma cells in vivo. Eur J Pharmacol. 645(1–3): 47–54.
- Reubi JC, Waser B, van Hagen M, Lamberts SW, Krenning EP, Gebbers JO, Laissue JA (1992). In vitro and in vivo detection of somatostatin receptors in human malignant lymphomas. Int J Cancer. 50(6): 895–900.
- Ribatti D, Conconi MT, Nussdorfer GG (2007). Nonclassic endogenous novel [corrected] regulators of angiogenesis. Pharmacol Rev. 59(2): 185–205.
- Rillema JA, Campbell GS, Lawson DM, Carter-Su C (1992). Evidence for a rapid stimulation of tyrosine kinase activity by prolactin in Nb2 rat lymphoma cells. Endocrinology. 131(2): 973–975.
- Ruscica M, Arvigo M, Steffani L, Ferone D, Magni P (2012). Somatostatin, Somatostatin Analogs and Somatostatin Receptor Dynamics in The Biology of Cancer Progression. Curr Mol Med. Aug 31. Epub ahead of print.
- Russell DH & Laird HE (1989). 3rd.Enhancement of prolactin (PRL)-stimulated mitogenesis of Nb2 rat lymphoma cell cultures by insulin-like growth factor I (IGF-I). Int J Immunopharmacol. 11(4): 359–366.
- Sarna S, Kumar A, Bhola RK (2000). Alpha-Tocopherol enhances tumour growth inhibition by cis-dichlorodiammine platinum (II). Braz J Med Biol Res. 33(8): 929–936.
- Sarna S & Bhola RK (1993). Chemo-immunotherapeutical studies on Dalton’s lymphoma in mice using cisplatin and ascorbic acid: synergistic antitumor effect in vivo and in vitro. Arch Immunol Ther Exp (Warsz). 41(5–6): 327–333.
- Sharma R & Vinayak M (2013). α-Tocopherol prevents lymphoma by improving antioxidant defence system of mice.
- Mol Biol Rep. 40(2): 839–849.
- Sharma R & Vinayak M (2012). Antioxidant α- tocopherol checks lymphoma promotion via regulation of expression of PKC-α, c-Myc genes and glycolytic metabolism. Leuk Lymphoma. 53(6): 1203–1210.
- Singh AT, Evens AM, Anderson RJ, Beckstead JA, Sankar N, Sassano A, et al (2010). All trans retinoic acid nanodisks enhance retinoic acid receptor mediated apoptosis and cell cycle arrest in mantle cell lymphoma. Br J Haematol. 150(2): 158–169.
- Singh MP, Sharma H, Singh SM (2006). Prolactin promotes growth of a spontaneous T cell lymphoma: role of tumor and host derived cytokines. Cancer Invest. 24(6): 601–610.
- Schmitz N, Nickelsen M, Ziepert M, Haenel M, Borchmann P, Schmidt C, et al. German High-Grade Lymphoma Study Group (DSHNHL) (2012). Conventional chemotherapy (CHOEP-14) with rituximab or high dose chemotherapy (MegaCHOEP) with rituximab for young, high-risk patients with aggressive B-cell lymphoma: an open-label, randomised, phase 3 trial (DSHNHL 2002- 1). Lancet Oncol. 13(12): 1250–1259.
- Sundaresan A, Claypool K, Mehta K, Lopez-Berestein G, Cabanillas F, Ford RJ Jr. (1997). Retinoid-mediated inhibition of cell growth with stimulation of apoptosis in aggressive B-cell lymphomas. Cell Growth Differ. 8(10): 1071–1082.
- Tejeda M, Gaal D, Hullan L, Csuka O, Schwab R, Szokoloczi O, Keri GY (2008). Evaluation of the antitumor efficacy of the somatostatin structural derivative TT-232 on different tumor models. Anticancer Res. 28(5A): 2769–2774.
- Trejo JL, Carro E, Garcia-Galloway E, Torres-Aleman I (2004). Role of insulin-like growth factor I signaling in neurodegenerative diseases. J Mol Med. 82(3): 156–162.
- Thomas JM & Hoffman BB (1989). Chronic somatostatin treatment induces enhanced forskolin-stimulated cAMP accumulation in wild-type S49 mouse lymphoma cells but not in protein kinase-deficient mutants. Mol Pharmacol. 35(1): 116–124.
- Trubiani O, Recchioni R, Moroni F, Pizzicannella J, Caputi S, Di Primio R (2005). Melatonin provokes cell death in human B-lymphoma cells by mitochondrial-dependent apoptotic pathway activation. J Pineal Res. 39(4): 425–431.
- Trump DL, Muindi J, Fakih M, Yu WD, Johnson CS (2006). Vitamin D compounds: clinical development as cancer therapy and prevention agents. Anticancer Res. 26(4A): 2551–2556.
- Turley JM, Funakoshi S, Ruscetti FW, Kasper J, Murphy WJ, Longo DL, et al (1995). Growth inhibition and apoptosis of RL human B lymphoma cells by vitamin E succinate and retinoic acid: role for transforming growth factor beta. Cell Growth Differ. 6(6): 655–63.
- Van den Anker-Lugtenburg PJ, Lowenberg B, Lamberts SW, Krenning EP (1996). The relevance of somatostatin receptor expression in malignant lymphomas. Metabolism. 45(8 Suppl 1): 96–97.
- Witzig TE, Letendre L, Gerstner J, Schroeder G, Mailliard JA, Colon-Otero G, et al (1995). Evaluation of a somatostatin analog in the treatment of lymphoproliferative disorders: results of a phase II North Central Cancer Treatment Group trial. J Clin Oncol. 13(8): 2012–2015.
- Woltering EA (2003). Development of targeted somatostatinbased antiangiogenic therapy: a review and future perspectives. Cancer Biother Radiopharm. 18(4): 601–609.
- Younes A, Cristofanilli M, McLaughlin P, Hagemeister FB, Weber D, Mesina O, Cabanillas F (2000). Experience with 9-cis retinoic acid in patients with relapsed and refractory non-Hodgkin’s lymphoma. Leuk Lymphoma. 40(1–2): 79–85.
- Yu W, Sanders BG, Kline K (1997). RRR-alpha-tocopheryl succinate inhibits EL4 thymic lymphoma cell growth by inducing apoptosis and DNA synthesis arrest. Nutr Cancer. 27(1): 92–101.
- Yu W, Sanders BG, Kline K (1996). Modulation of murine EL-4 thymic lymphoma cell proliferation and cytokine production by vitamin E succinate. Nutr Cancer. 25(2): 137–149.
- Zhang C, Hazarika P, Ni X, Weidner DA, Duvic M (2002). et al. Induction of apoptosis by bexarotene in cutaneous T-cell lymphoma cells: relevance to mechanism of therapeutic action. Clin Cancer Res. 8(5): 1234–1240.
- Zhou T, Xiao X, Xu B, Li H, Zou Y (2009). Overexpression of SSTR2 inhibited the growth of SSTR2-positive tumors via multiple signaling pathways. Acta Oncol. 48(3): 401–410.
- Zyrina GV (2012). [Lesions in the nervous system during chemotherapy of acute leukosis and non-Hodgkinlymphomas]. Klin Med (Mosk). 90(6): 73–75. Russian.

