Glioblastoma Multiforme (Grade IV WHO 2007) : remissione completa di un paziente trattato con MDB, in recidiva dopo asportazione chirurgica
Pubblicato il 15/06/2015
In un uomo dell’ età di 41 anni, con diagnosi di Glioblastoma Multiforme (Grado IV – WHO 2007) e prognosi sfavorevole, per recidiva loco-regionale dopo trattamento convenzionale (chirurgia + RT + Temolozomide), si è ottenuta una risposta obiettiva completa attraverso la somministrazione concomitante, e ben tollerata, di Somatostatina + Octreotide a lento rilascio, Melatonina, Retinoidi solubilizzati in Vitamina E, Vit. D3 ,Vit C e Temolozomide.
Tale risultato, oltre al positivo ed inedito riscontro terapeutico, ha permesso al paziente di evitare il trauma di ulteriore intervento chirurgico, gli eventuali rischi correlati, mantenendo nel contempo la propria consueta attività lavorativa.
PREMESSE
Il glioblastoma (GBM) è ancora un problema clinico irrisolto, ed è il tumore più comune e più maligno tra le neoplasie della glia.
La guarigione può essere ottenuta, in casi molto rari, unicamente laddove possa venire praticata la rimozione chirurgica della totalità del tessuto neoplastico, c he viene generalmente fatta seguire da un trattamento combinato radioterapia - temozolomide che, risultando mediamente ben tollerato e con una tossicità aggiuntiva minimale, è diventato lo standard terapeutico di elezione per tutti i nuovi pazienti con gliob lastoma.
In caso di recidiva della malattia (che si verifica nella quasi totalità dei glioblastomi), o di espansione della parte di tessuto non rimosso dall'operazione chirurgica, o di radio - necrosi (sia la ripresa di malattia che la radio - necrosi causano effetto massa ed edema e, non sono distinguibili alla risonanza classica) si ricorre ad un secondo intervento, per ridurre gli effetti della massa neo - formata sul parenchima cerebrale. In caso di recidiva molto difficilmente si raggiunge la guarigione, com unque ne consegue di solito un miglioramento della qualità della vita e un modesto incremento della sopravvivenza.
La Chirurgia è la terapia di elezione nel trattamento del Glioblastoma.
L'approccio chirurgico deve essere valutato accuratamente, allo scopo di ottenere la massima asportazione del tumore, per ridurne l'effetto massa sul cervello e/o dall'edema peritumorale, preservando le strutture vitali dell’organo e cercando di minimizzare il rischio di deficit neurologico postoperatorio. La riduzione delle dimensioni della massa inoltre, anche se non definitiva, ne consente una più efficace gestione successiva mediante trattamenti radio e chemioterapici.
Un'asportazione maggiore del 98% del volume del tumore (resezione “totale”) aumenta la sopravvivenza rispetto ad una resezione subtotale o parziale. La resezione subtotale “estesa” non sembra conferire alcun vantaggio di sopravvivenza rispetto alla biopsia o alla resezione parziale. (*Laws ER et al 2003).
Statisticamente, la sopravvivenza dei pazienti tra ttati con chirurgia, radioterapia e chemioterapia è di circa 1 anno (57% a 1 anno, 16% a 2 anni e 7% a 3 anni) (*Filippini et al 2007) .
Dopo i 3 anni, in letteratura, si parla di "lunga sopravvivenza".
Tale risultato, oltre al positivo ed inedito riscontro terapeutico, ha permesso al paziente di evitare il trauma di ulteriore intervento chirurgico, gli eventuali rischi correlati, mantenendo nel contempo la propria consueta attività lavorativa.
PREMESSE
Il glioblastoma (GBM) è ancora un problema clinico irrisolto, ed è il tumore più comune e più maligno tra le neoplasie della glia.
La guarigione può essere ottenuta, in casi molto rari, unicamente laddove possa venire praticata la rimozione chirurgica della totalità del tessuto neoplastico, c he viene generalmente fatta seguire da un trattamento combinato radioterapia - temozolomide che, risultando mediamente ben tollerato e con una tossicità aggiuntiva minimale, è diventato lo standard terapeutico di elezione per tutti i nuovi pazienti con gliob lastoma.
In caso di recidiva della malattia (che si verifica nella quasi totalità dei glioblastomi), o di espansione della parte di tessuto non rimosso dall'operazione chirurgica, o di radio - necrosi (sia la ripresa di malattia che la radio - necrosi causano effetto massa ed edema e, non sono distinguibili alla risonanza classica) si ricorre ad un secondo intervento, per ridurre gli effetti della massa neo - formata sul parenchima cerebrale. In caso di recidiva molto difficilmente si raggiunge la guarigione, com unque ne consegue di solito un miglioramento della qualità della vita e un modesto incremento della sopravvivenza.
La Chirurgia è la terapia di elezione nel trattamento del Glioblastoma.
L'approccio chirurgico deve essere valutato accuratamente, allo scopo di ottenere la massima asportazione del tumore, per ridurne l'effetto massa sul cervello e/o dall'edema peritumorale, preservando le strutture vitali dell’organo e cercando di minimizzare il rischio di deficit neurologico postoperatorio. La riduzione delle dimensioni della massa inoltre, anche se non definitiva, ne consente una più efficace gestione successiva mediante trattamenti radio e chemioterapici.
Un'asportazione maggiore del 98% del volume del tumore (resezione “totale”) aumenta la sopravvivenza rispetto ad una resezione subtotale o parziale. La resezione subtotale “estesa” non sembra conferire alcun vantaggio di sopravvivenza rispetto alla biopsia o alla resezione parziale. (*Laws ER et al 2003).
Statisticamente, la sopravvivenza dei pazienti tra ttati con chirurgia, radioterapia e chemioterapia è di circa 1 anno (57% a 1 anno, 16% a 2 anni e 7% a 3 anni) (*Filippini et al 2007) .
Dopo i 3 anni, in letteratura, si parla di "lunga sopravvivenza".
IL CASO
Il paziente (età 41) all’inizio del mese di ottobre 2012 presenta insorgenza di cefalea ingravescente non responsiva a terapia, con caratteristiche invalidanti.
Le indagini diagnostiche immediatamente successive evidenziano “neoformazione parieto - occipitale destra di colorito grigiastro, biloba ta. Disomogenea. Diffusamente sanguinante. Non capsulata, di consistenza molle e aspetto infiltrativo ( Fig.1 ). All’interno della lesione aree cistiche ed emorragico - necrotiche.”
SPETTROSCOPIA: “Riduzione NAA picco di colina e di lattato, indice di neoplasi a gliale ad alta aggressività.”
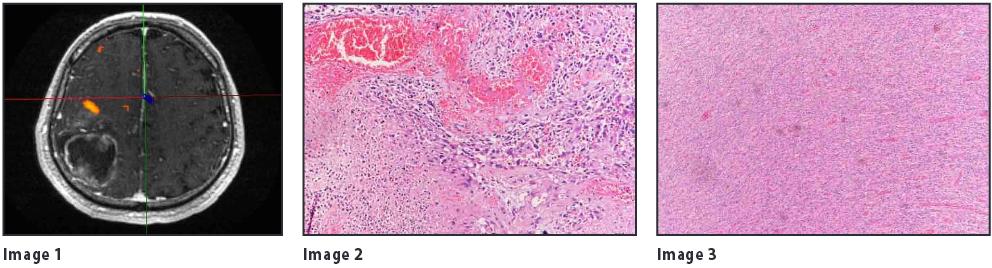
16 - 10 - 2012 – Intervento chirurgico di rimozione - Diagnosi Istologica e Immunoistochimica
Glioblastoma (grado IV WHO 2007)
EGFR: intensa e diffusa positività di membrana e citoplasmatica nel 90% del tessuto neoplastico
Ki67: frazione di cellule proliferanti: 30%
PTEN : positivo
26 - 10 - 2012 – RM “”..dopo MDC compaiono, anteriormente al cavo chirurgico, alcune piccole immagini rotondeggianti con cercine iperintenso, sospette per residuo e/o recidiva neoplastica...””
02 - 11 - 2012 – TAC con MDC “”... persiste, dopo somministrazione di mdc, la presenza di formazione plurilobata cercinata, da residuo e/o ripresa di neoplasia...””
In attesa di affrontare il successivo percorso terapeutico ( Temodal + Radioterapia) al paziente viene prescritta la somministrazione continuativa (nel tempo) dei seguenti principi farmacologici
Somatostatina - Octreotide - Melatonina - Retinoidi - Vit. D3 - Tetracosactide - Cabergolina - Bromocriptina .
03 - 12 - 2012/18 - 01 - 2013 RADIOTERAPIA + Temodal (140mg/gg per 5 giorni/settimana)
Successivamente, dopo una sospensione della somministrazione per 4 settimane, il Temodal viene somministrato per 5 giorni continuativi (300 mg/gg) ogni 4 settimane.
5 - 06 - 2013 – RM“”...persiste, anche se meno evidente, l’ irregolare impregnazione del mdc del letto operatorio con presenza di formazione con aspetto nodulare di circa 20 mm...... non più evidente l’altra nodulazione di circa 8 mm sul profilo posteriore. Ridotta la modularità di aspetto cercinato localizzata in sede profonda frontale dx che attualmente misura circa 11 mm (vs 16 mm)....””
18 - 09 - 2013 – RM e SPETTROSCOPIA “”... rispetto al precedente controllo minore impregnazione di mdc del letto operatorio, non più evidente la formazione nodulare precedentemente segnalata, nettamente ridotta la formazione cercinata localizzata in sede profonda frontale posteriore dx che attualmente appare appena percettibile come focalità lineare di circa 4 mm. La SPETTROSCOPIA con tecnica multivaxel, con ROI posizionate nella sede lesionale e nel tessuto sano, non ha documentato significative variazioni dei metaboliti noti nella sede lesionale rispetto al tessuto sano...””
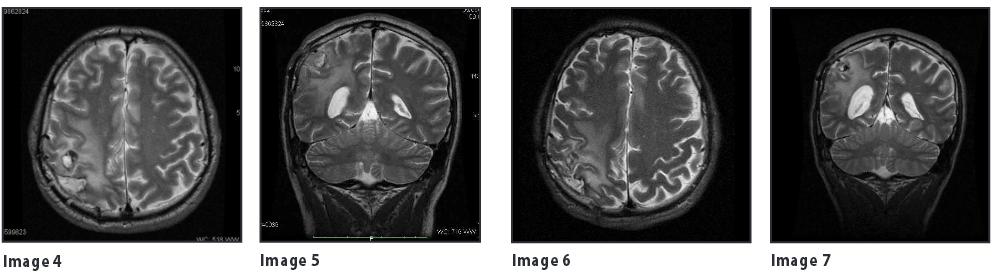
06 - 02 - 2014 – RM e SPETTROSCOPIA “”.. ulteriore riduzione dell’impregnazione delle pareti del letto operatorio. Non immagini nodulari in tale sede. Non più evidente la focalità lineare di impregnazione in sede frontale posterior e dx precedentemente segnalata. (Fig. 6 – 7) Ridotto anche l’alone edematoso con minima compressione sul trigono ventricolare di dx, che appare più espanso rispetto al precedente controllo. La SPETTROSCOPIA con tecnica multivaxel, con ROI posizionate nell a sede lesionale e nel tessuto sano, non ha documentato significative variazioni dei metaboliti noti nella sede lesionale rispetto al tessuto sano...””
LA TERAPIA
- Somatostatina (14 amminoacidi) 3 mg - sottocutanea (giornaliero, tutte le notti – 12 ore di infusione)
- Octreotide LAR 20 mg (8 amminoacidi)) 20 mg intramuscolare (ogni 3 settimane)
- Melatonina coniugata (12% - Adenosina 51% - Glicina 37% ) 100 mg (giornaliero - orale)
- Soluzione di Retinoidi - 8 ml. - orale (3 volte al giorno) (ATRA 0,5 g - Axeroftole Palm. 0,5 g - BetaCarotene 2 g.Alpha Tocopheryl Acet. 1000 g.)
- Vit. D3 - 1,25 - diOH - Tachysterol - orale (3 volte al giorno )
- Tetracosactide Acetato 0,25 mg intramuscolo (2 volte alla settimana)
- Cabergolina 0,5 mg - ½ cps – orale (2 volte alla settimana)
- Bromocriptina 2,5 mg - ½ cps – orale (2 volte al giorno)
- Temodal (300 mg/giorno) ogni 4 settimane (ridotto a 200 mg)
RISULTATI E FOLLOW - UP
Attualmente il paziente non presenta sostanziali modificazioni della situaz ione clinica sopra descritta. In seguito al risultato ottenuto è stata ridotta la somministrazione del Temodal a 200 mg/gg x 5 giorni ogni 4 settimane, mantenendo inalterata la prescrizione degli altri principi farmacologici.
DISCUSSIONE
La proliferazione cellulare fisiologica e neoplastica è strettamente dipendente dalla Prolattina, dal GH, massimo induttore della crescita [*De Souza et al., l974; *Lincoln et al., 1998; Friend et al., 2000; *Barnett et al., 2003; *Anthony et al., 2009 ;] e da molecole mitogene GH dipendenti, da esso positivamente regolate, come EGF, FGF, HGF, IGF1 - 2, NGF, PDGF, TGF, VEGF [ *Szepesházi et al., 1999; *Murray et al., 2004; *Sall et al., 2004; *; *Hagemeister et al., 2008; *Taslipinar et al., 2009] ] oltre che da fattori di crescita prodotti dall’apparato gastrointestinale, come VIP, CCK, G [*Kath et al., 2000].
I fenomeni di proliferazione incontrollata e la perdita di differenziazione, anche se in misura diversa, sono denominatori comuni a tutte le neopla sie .Numerosi studi indicano come gli ormoni pituitari GH e PRL, abbiano un ruolo cruciale nello sviluppo e nella progressione dei tumori umani. La loro espressione recettoriale è ubiquitaria [*De Souza et al., l974; *Ben - Jonathan et al., 2002; Batra RK e t al, 1997; Cameron et al 1979] con rapporto dose/dipendente tra l’espressione recettoriale del GH e i processi di induzione e progressione tumorale, rilevato istochimicamente ed attraverso tecniche di Western Blot, Ibridazione in situ e qPCR . La docume ntazione di concentrazioni di GHR nettamente superiori nei tessuti tumorali rispetto a quelli fisiologici e peritumorali, ne conferma il potente ruolo mitogeno [*Lincoln et al., 1998;*Friend et al., 2000; *Zeitler et al., 2000; *Gruszka et al., 2001] Attualmente è in fase di studio la meccanica temporale di tale processo etiopatogenetico: tra le ipotesi più verosimili, sono stati suggeriti, in aggiunta all’increzione ipofisaria di GH e PRL, probabili meccanismi di segnalazione autocrina e/o paracrina, sulla base della rilevazione della produzione locale del GH, GHR,PRL PRLR e del IGFI nei tessuti di molte varietà di neoplasie, tra cui tumori del sistema nervoso.
L’impiego della somatostatina e analoghi, agendo sui maggiori oncogeni, trova indicazione razionale in ogni neoplasia; [Di Bella L et al., 1979;Di Bella L.1981; *Di Bella et al., 1997; *Di Bella L et al., 1998 *Pollak , Schally et al., 1997; *Pawlikowski et al., 1998; *Friend et al., 2000; *Lachowicz et al., 2000; *Friend et al., 2000; (NO)Sch ally et al., 2001; *Massa et al., 2004;; *Arena et al., 2007; *Guillermet - Guibert et al., 2007; *Lee et al., 2008; *Verhoef et al., 2008; *Vieira Neto et Di Bella G. 2010 ]. L’asse PRL/GH/GF ha una determinate influenza sullo sviluppo biologico neoplastic o, da ciò l’evidenza logica e razionale dell’impiego antitumorale sinergico e interattivo di agonisti anti - prolattinemici di D2R cn antagonisti biologici del GH, come Somatostatina e analoghi, che estendono la loro regolazione negativa a fattori di cresc ita altamente mitogeni, GH dipendenti, come IGF1 - 2 [Arena S. et al 2007; Bucklei AR et al 2000, Cameron et al 1991], EGF [*Watt HL et al., Barrie R. et al 1993], FGF [Bonneterre et al 1990], VEGF [Albini A 1999;Cascinu S et al 2001 ; Ashino H et al 2003] PDGF [Cattaneo MG.et al 1999] e alle vie di segnalazione recettoriali, con conseguenti riflessi anti - proliferativi, pro - apoptotici, differenziativi ed anti - angiogenici [*Watt HL et al 2008]. Tale visione sta lentamente emergendo attraverso le sempre più frequenti ricerche di base, sebbene ancora raramente applicati sull’uomo.
In molti tumori, non solo in quelli neuroendocrini, è stata documentata un’espressione recettoriale per la somatostatina [*Moertel et al., 1994; *Sestini et al., 1996; *Kogner et al ., 1997; *Briganti et al., 1997; *Van Eijck et al., 1998; *Borgström et al., 1999; *Friend et al., 2000; *Albérini et al., 2000; *Florio et al., 2000; *Cattaneo et al., 2000; *Steták et al., 2001;* Orlando et al., 2001; *Faggiano et al., 2008; *Florio et a l., 2008; *Fusco et al., 2008; *Kwekkeboom et al., 2008; *Hubalewska - Dydejczyk et al., 2008; Watt HL et al 2008 *Ioannou et al.,2008; *Khanna et al., 2008; Li et al., 2008; *Corleto et al., 2009; *Edelman et al., 2009; *Hassaneen et al., 2009; *He et al., 2009; *Laklai et al., 2009; *Luboldt et al., 2009; *Pisarek et al., 2009; *Ruscica et al., 2010].
Studi su cellule cerebrali sane e di glioblastoma hanno evidenziato la presenza di mRNA GHR in tutti i campioni cerebrali esaminati . Tecniche immunoistoch imiche e il western blotting hanno confermato l’esistenza dell’espressione del GHR nel SNC, supportando il ruolo del GH nella fisiologia del SNC e maggiormente nelle neoplasie. (*Castro JR et al 2000).
E’ confermata inoltre anche nelle neoplasie del SN C un’espressione nettamente superiore di GH e GHR nei tessuti tumorali rispetto a quelli sani (*Lincoln DT et al 1998) .Nelle cellule di glioblastoma è stata dimostrata l’efficacia antitumorale degli analoghi della somatostatina e la correlazione tra la loro attività antitumorale e la capacità di inibire il rilascio del GH, antagonizzando il GHRH.
L’ormone ipotalamico GHRH, stimola la sintesi e il rilascio del GH dalla ghiandola ipofisaria, il suo mRNA è stato trovato in concentrazione nettamente inc rementate sia nei tessuti tumorali cerebrali, che della mammella, ovaio, prostata, polmone ecc... rispetto ai tessuti sani. Diversi studi hanno dimostrato che gli analoghi della somatostatina antagonisti del GHRH attraversano inoltre senza difficoltà la b arriera emato - encefalica (*Jaeckle LB et al 2003) e, inibendo il GH, hanno effetti antiproliferativi in molti modelli tumorali cerebrali , tra cui i glioblastomi. *Kovács M et al 2010).
I IGFR rispondono mitogenicamente al IGF,e l’effetto soppressivo d ella SST e analoghi, sui livelli sierici di IGF1, è sia diretto, attraverso l’inibizione del gene di IGF, che indiretto, mediante la soppressione del GH e pertanto della sua induzione epatica di IGF1.
L’effetto anti - proliferativo degli analoghi della somat ostatina anche nei tumori cerebrali come in altre neoplasie si realizza pertanto anche attraverso meccanismi che coinvolgono la soppressione del sistema IGF (*Kiaris H et al 2005).La regressione e la lunga sopravvivenza con somatostatina di un gliosarcoma primario, neoplasia rara a prognosi infausta a breve (considerato una variante di glioblastoma multiforme come una neoplasia di IV grado), conferma l’efficacia e l’indicazione della SST in questa patologia. (*Trignani M et al 2013).
REFERENZE
- Albini A, Florio T, Giunciuglio D, Masiello L, Carlone s , Corsaro A et al. (1999). somatostatin controls Kaposi’s sarcoma tumor growth through inhibition of angiogenesis. f A s EB J. 13 (6): 647–655.
- Ashino H, Shimamura M, Nakajima H, Dombou M, Kawanaka s , Oikawa T, Iwaguchi T, Kawashima s (2003). Novel function of ascorbic acid as an angiostatic factor. Angiogenesis. 6 (4): 259–269.
- Batchelor TT, Reardon DA, de Groot JF , Wick W, Weller M (2014). Antiangiogenic therapy for glioblastoma: current status and future prospects. clin cancer Res. 20 (22): 5612–5619.
- Ben-Jonathan N, Liby K, Mc Farland M, Zinger M (2002). Prolactin as an autocrine/paracrine growth factor in human cancer. Trends Endocrinol Metab. 13 (6): 245–250.
- Campos B, Wan F , Farhadi M, Ernst A, Zeppernick F , Tagscherer KE (2010). Differentiation therapy exerts antitumor effects on stemlike glioma cells. Clin Cancer Res. 16 (10): 2715–2728.
- Cascinu s , Del Ferro E, Ligi M, Staccioli MP, Giordani P, Catalano V et al. (2001). Inhibition of vascular endothelial growth factor by octreotide in colorectal cancer patients. c ancer Invest. 19 (1): 8–12.
- Castro JR, Costoya JA, Gallego R, Prieto A, Arce VM, Señarís R (2000). Expression of growth hormone receptor in the human brain. Neurosci Lett. 281 (2–3): 147–150.
- Cenciarelli C, Marei HE, Zonfrillo M, Pierimarchi P, Paldino E, Casalbore P, Felsani A, Vescovi AL, Maira G, Mangiola A (2014). PDGf receptor alpha inhibition induces apoptosis in glioblastoma cancer stem cells refractory to anti-Notch and anti-EGFR treatment. Mol c ancer. 13 (1): 247.
- Ciccarelli E, Razzore P, Gaia D, Todaro C, Longo A, Forni M, Ghè c ,C amanni f et al. (2001). Hyperprolactinaemia and prolactin binding in benign intracranial tumours. J Neurosurg s ci. 45 (2): 70–74.
- Crough T, Beagley L, Smith C, Jones L, Walker DG, Khanna R (2012). Ex vivo functional analysis, expansion and adoptive transfer of cytomegalovirus-specific T-cells in patients with glioblastoma multiforme. Immunol c ell Biol. 90 (9): 872–880.
- Das A, Banik NL, Ray s K (2008). Retinoids induced astrocytic differentiation with down regulation of telomerase activity and enhanced sensitivity to taxol for apoptosis in human glioblastoma T98G and U87MG cells. J Neurooncol. 87 (1): 9–22. Epub 2007 Nov 7.
- De Souza I, Morgan L, Lewis UL, Raggatt PR, Salih H, Hobbs JR (1974). Growth-hormone dependence among human breast cancers. Lancet. 2 (7874): 182–184.
- Di Bella L, Gualano L (2006). Key aspects of melatonin physiology: thirty years of research. Neuro Endocrinol Lett. 27 (4): 425–432.
- Di Bella G (2010). The Di Bella Method (DBM). Neuro Endocrinol Lett. 31 ( s uppl 1): 1–42. 1
- Filippini G, Falcone c , Boiardi A, Broggi G, Bruzzone MG, Caldiroli D, Farina R, Farinotti M, et al. (2008). Prognostic factors for survival in 676 consecutive patients with newly diagnosed primary glioblastoma. Neuro Oncol. 10 (1): 79–87.
- Friend KE (2000). Targeting the growth hormone axis as a thera - peutic strategy in oncology . Growth Horm IG FRes. 10 ( s uppl A): s 45–6. Review.
- Gruszka A, Pawlikowski M, Kunert-Radek J (2001). Anti-tumoral action oFoctreotide and bromocriptine on the experimental rat prolactinoma: anti-proliferative and pro-apoptotic effects. Neuro Endocrinol Lett. 22 (5): 343–348.
- Hagemeister AL, Sheridan MA (2008). Somatostatin inhibits hepatic growth hormone receptor and insulin-like growth factor I mRNA expression by activating the ERK and PI3K signaling pathways. Am J Physiol Regul Integr Comp Physiol. 295 (2): R490–497.
- Heute D, Kostron H, von Guggenberg E, Ingorokva s , Gabriel M, Dobrozemsky G, Stockhammer G, Virgolini IJ (2010). Response of recurrent high-grade glioma to treatment with (90)Y-DOTATO c . J Nucl Med. 51 (3): 397–400.
- Jaeckle KA, Hess KR, Yung WK, Greenberg H, Fine H, Schif et al. (2003). Phase II evaluation of temozolomide and 13-cis-retinoic acid for the treatment of recurrent and progressive malignant glioma: a North American Brain Tumor Consortium study. J c lin Oncol. 21 (12): 2305–2311.
- Jaeger LB, Banks WA, Varga JL, Schally AV (2005). Antagonists of growth hormone-releasing hormone cross the blood-brain barrier: a potential applicability to treatment of brain tumors. Proc Natl Acad s ci U s A. 102 (35): 12495–12500.
- Karsy M, Albert L, Tobias ME, Murali R, Jhanwar-Uniyal M (2010). All-trans retinoic acid modulates cancer stem cells of glioblastoma multiforme in an MAPK-dependent manner. Anticancer Res. 30 (12): 4915–4920.
- Kath R, Höffken K (2000). The significance of somatostatin analogues in the antiproliferative treatment of carcinomas. Recent Results c ancer Res. 153 : 23–43.
- Kiaris H, Schally AV, Kalofoutis A (2005). Extrapituitary effects of the growth hormone-releasing hormone. Vitam Horm. 70 : 1–24.
- Kiaris H, Schally AV (1999). Decrease in telomerase activity in U-87MG human glioblastomas after treatment with an antagonist of growth hormone-releasing hormone. Proc Natl Acad s ci U s A. 96 (1): 226–231.
- Kini AR, Peterson LA, Tallman M s , Lingen MW (2001). Angiogenesis in acute promyelocytic leukemia: induction by vascular endothelial growth factor and inhibition by all-trans retinoic acid. Blood. 97 (12): 3919–3924.
- Kisker O, Onizuka s , Beckerc M, Fannon M, Flynn E, D‘Amato R et al. (2003). Vitamin D binding protein-macrophage activating factor (DBP-maf) inhibits angiogenesis and tumor growth in mice. Neoplasia. 5 (1): 32–40.
- Kovács M, s chally AV, Hohla f , Rick f G, Pozsgai E, Szalontay L, Varga JL, Zarándi M (2010). A correlation of endocrine and anticancer effects of some antagonists of GHRH. Peptides. 31 (10): 1839–1846.
- Laws ER, Parney I f , Huang W, Anderson f , Morris AM, Asher A et al. (2003). s urvival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg. 99 (3): 467–473.
- Lincoln DT, Sinowatz f , Temmim-Baker L, Baker HI, Kölle s , Waters MJ (1998). Growth hormone receptor expression in the nucleus and cytoplasm of normal and neoplastic cells. Histochem c ell Biol. 109 (2): 141–159.
- Lissoni P, Giani L, Zerbini S , Trabattoni P, Rovelli F (1998). Biotherapy with the pineal immunomodulating hormone melatonin versus melatonin plus aloe vera in untreatable advanced solid neoplasms. Nat Immun. 16 (1): 27–33.
- Lissoni P, Rovelli F , Malugani f , Bucovec R, Conti A, Maestroni GJ (2001). Anti-angiogenic activity of melatonin in advanced cancer patients. Neuro Endocrinol Lett. 22 (1): 45–47.
- Liu Y, Yang H, Otaka K, Takatsuki H, Sakanishi A (2005). Effects of vascular endothelial growth factor (VEG f ) and chondroitin sulfate A on human monocytic THP-1 cell migration. Colloids surf B Biointerfaces. 43 (3–4): 216–220.
- Mendes GA, Pereira-Lima J f , Kohek MB, Trott G, Di Domenico M, Ferreira NP, Oliveira Mdac (2013). Prolactin gene expression in primary central nervous system tumors. J Negat Results Biomed. 12 (1): 4.
- Merchant TE, Goloubeva O, Pritchard DL, Gaber MW, Xiong X, Danish RK, Lustig RH (2002). Radiation dose-volume effects on growth hormone secretion. Int J Radiat Oncol Biol Phys. 52 (5): 1264–1270.
- Mishima M, Yano T, Jimbo H, Yano N, Morita Y, Yoshikawa H, Schally AV, Taketani Y (1999). Inhibition of human endometrial cancer cell growth in vitro and in vivo by somatostatin analog R c -160. Am J Obstet Gynecol. 181 (3): 583–590.
- Mizumoto M, Okumura T, Ishikawa E, Yamamoto T, Takano s , Matsumura A et al. (2013). Reirradiation for recurrent malignant brain tumor with radiotherapy or proton beam therapy. Technical considerations based on experience at a single institution. s trahlenther Onkol. 189 (8): 656–663.
- Neuzil J, Kågedal K, Andera L, Weber c , Brunk UT (2002). Vitamin E analogs: a new class of multiple action agents with anti-neoplastic and antiatherogenic activity. Apoptosis. 7 (2): 179–187.
- Oliveira- f errer L, Wellbrock J, Bartsch U, Penas EM, Hauschild J, Klokow M et al. (2013). Combination therapy targeting integrins reduces glioblastoma tumor growth through antiangiogenic and direct antitumor activity and leads to activation of the pro- proliferative prolactin pathway. Mol c ancer. 12 (1): 144.
- Orecchia R, Vitolo V, Fiore MR, Fossati P, Iannalfi A, Vischioni B et al. (2014). Proton beam radiotherapy: report of the first ten patients treated at the “ centro Nazionale di Adroterapia Oncologica ( CNAO)” for skull base and spine tumours. Radiol Med. 119 (4): 277–282.
- Sokrzadeh M, Ahmadi A, Naghshvar f , Chabra A, Jafarinejhad M (2014). Prophylactic efficacy of melatonin on cyclophos phamide induced liver toxicity in mice. Biomed Res Int. 2014 : 470425.
- Trignani M, Taraborrelli M, Ausili c èfaro G (2013). The case of a patient affected by primary gliosarcoma and neuroendocrine pancreatic cancer with prolonged survival. Tumori. 99 (3): e117– 119.
- Taslipinar A, Bolu E, Kebapcilar L, Sahin M, Uckaya G, Kutlu M (2009). Insulin-like growth factor-1 is essential to the increased mortality caused by excess growth hormone: a case of thyroid cancer and non-Hodgkin‘s lymphoma in a patient with pituitary acromegaly. Med Oncol. 26 (1): 62–66.
- Turner HE, Nagy Z, Gatter KC , Esiri MM, Harris AL, Wass JA (2000). Angiogenesis in pituitary adenomas relationship to endocrine function, treatment and outcome. J Endocrinol. 165(2): 475–481.
- Zeitler P, Siriwardana G (2000). Stimulation of mitogen-activated protein kinase pathway in rat somatotrophs by growth hormone-releasing hormone. Endocrine. 12 (3): 257–264.
Clicca qui per leggere la relazione completa (versione ITA)

