Studio di fase II su linfomi non-Hodgkin di basso grado in stadio avanzato.
Pubblicato il 19/06/2014
Cancer Biotherapy & Radiopharmaceuticals
Volume 16, Number 2, 2001 Mary Ann Liebert, Inc.
Ciclofosfamide più somatostatina, bromocriptina, retinoidi, melatonina e ACTH nel trattamento dei linfomi non-Hodgkin di basso grado in stadio avanzato: risultati di una sperimentazione di fase II.
Mauro Todisco, MD, Piergiorgio Casaccia, MD e Nazzareno Rossi, ASL 13 in Sondrio e ASL 106 in Teramo.
Scopo:
E' stato dimostrato che la somatostatina, la prolattina, i retinoidi, la melatonina e l'ACTH influenzano la crescita linfatica, e l'azione del ciclofosfamide nei disordini linfoproliferativi è ben nota. Questo fornì le basi per condurre, in pazienti con linfomi non-Hodgkin di basso grado (NHL), una sperimentazione di fase II di un'associazione combinata di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH.
Pazienti e metodi
Venti pazienti con una diagnosi di NHL di basso grado, di stadio III o IV, furono inclusi in questo studio. I pazienti ricevettero per un mese il seguente trattamento: ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH. La terapia fu continuata per altri due mesi in pazienti con malattia stabile e rispondente. Dopo tre mesi, i pazienti che rispondevano alla terapia la continuarono per tre mesi e più. Risultati Venti pazienti furono valutabili per tossicità e risposta; 70% (14 di 20 pazienti; 95% di intervallo di confidenza [CI], da 50% a 90%) ebbero una parziale risposta; il 20% (4 su 20) ebbero una malattia stabile, e il 10% (2 su 20) progredirono con la terapia. Continuando con la terapia, nessuno dei 14 pazienti con una risposta parziale ebbe una progressione della malattia (tempo di controllo medio di 21 mesi, gamma, da 7 a 25), e il 50% di questi pazienti ebbe una completa risposta e il 75% (3 di 4) progredirono con la terapia (tempo medio di progressione [TTO] 14.3 mesi, gamma, da 7 a 21). La tossicità era molto modesta, gli effetti collaterali più comuni furono: sonnolenza, diarrea e iperglicemia. Conclusioni L'associazione di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH è ben tollerata ed efficace nel trattamento del NHL di basso grado ad uno stadio avanzato.
INTRODUZIONE
Di recente è stato dimostrato che nuovi agenti inibiscono la crescita linfatica. Tra questi, soprattutto quelli senza tossicità per il midollo osseo, come la somatostatina, suscitarono grande interesse per la possibilità di utilizzarli con regimi di chemioterapia mielosoppressivi senza determinare un ulteriore mielosoppressione. Un'associazione come questa fu proposta per la prima volta nel 1979 da Di Bella e altri, che utilizzarono il ciclofosfamide insieme con la somatostatina, la bromocriptina, i retinoidi, la melatonina e l'ACTH in diversi tipi di cancro, inclusi i linfoma non-Hodgkin (NHL). Sulla base di questa associazione farmacologica, in particolare dell'uso della somatostatina e della bromocriptina, esiste l'assunto, formulato da Di Bella, che l'ormone della crescita (GH) e la prolattina sono coinvolti nella crescita neoplastica. Tale assunto, nella leucemia linfoblastica acuta, fu formulato anche da altri autori, nello stesso periodo, anche se solo per il GH. Successivamente, Payan e altri limostrarono che la somatostatina inibisce la crescita di linfociti umani primari in coltura e di cellule Molt-4; Nakamura e altri identificarono i recettori della somatostatina sulla membrana di diverse linee di cellule linfoidi e Hiruma e altri scoprirono i recettori della somatostatina sulle cellule umane di leucemia primaria. Inoltre, fu dimostrato che la maggior parte delle lesioni linfomatose sono identificabili con gli analoghi radiomarcati della somatostatina. In accordo con i risultati sopra menzionati, Witzig e altri nel 1995 affermarono che l'octreotide, un analogo della somatostatina, mostra attività in pazienti con il NHL di basso grado. L'influenza sulla crescita linfatica è stata anche dimostrata per la prolattina, i retinoidi, la melatonina e l'ACTH. È stato dimostrato che la prolattina stimola la crescita dei linfomi sperimentali, sia in vivo che in vitro, e i recettori della prolattina sono presenti sulla superficie delle cellule linfoidi neoplastiche e normali. Matera e altri dimostrarono che la prolattina è una fattore di crescita autocrino per una linea di cellule leucemiche umane, e Hooghe e altri ritornarono all'ipotesi, già sostenuta da Di Bella, che la prolattina e il GH hanno un ruolo importante nel linfoma e nella leucemia. In ematologia, l'effetto antitumorale dei retinoidi è basato su diverse prove dell'effetto dell'acido trans retinoico nella leucemia promielocitica, nel linfoma delle cellule T localizzato nella pelle e anche nei linfomi delle cellule B. La melatonina inibisce l'incorporazione di timidina nei normali linfociti e nelle linee di cellule linfoblastoidi e inibisce la risposta proliferativa ai fitogeni. Inoltre la melatonina porta avanti un azione antimielodisplastica e diminuisce la tossicità per il midollo osseo degli agenti chemioterapici. E' stato dimostrato che i linfociti T e B presentano il recettore dell'ACTH sulla superficie delle loro cellule; inoltre l'ACTH abbassa la blastogenesi dei linfociti in risposta alla fitoemaglutinina e alla concanavallin A e ha un ruolo nella modulazione dell'attività delle cellule NK. Questi studi, insieme alla ben nota azione del ciclofosfamide, fornirono la base per disegnare uno studio di fase II per determinare se una terapia combinata di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH ha un'attività in pazienti con il NHL di basso grado in stadio avanzato.
PAZIENTI E METODI
Selezione dei pazienti
I pazienti furono selezionati sulla base di una diagnosi clinica di NHL di basso grado, stadio III o IV. Criteri addizionali di selezione furono: uno stato di esecuzione (PS) tra 0 e 3, secondo l'Eastern Cooperative Oncology Group, e la presenza di lesione misurabile bidimensionalmente, come dimostrato dall'esame fisico, dalla radiografia del torace, dall'ecotomografia, dalla tomografia computerizzata o risonanza magnetica.
I pazienti che avevano ricevuto altri trattamenti furono inclusi in questo studio solo se il primo trattamento non era stato efficace. Ai pazienti che ricevevano la chemioterapia fu chiesto di sospendere la somministrazione di qualunque farmaco per almeno 15 giorni prima di iniziare la terapia combinata. La tossicità fu valutata usando criteri sviluppati dall'Organizzazione Mondiale per la Sanità. Trattamento I pazienti ricevettero una combinazione di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH. Il ciclofosfamide fu somministrato oralmente ad una dose di 75 mg/giorno (50 mg alle 14:00 e 25 alle 21:00). La somatostatina fu somministrata sottocute (SQ) ad una dose di 1,5 mg/giorno entro 8 ore usando una siringa a pompa. La somministrazione iniziò almeno tre ore dopo la cena e quei pazienti che erano psicologicamente incapaci di accettare questo tipo di somministrazione ricevettero una singola iniezione SQ di octreotide (0,5 mg/giorno) tre ore dopo la cena.
La bromocriptina fu somministrata oralmente ad una dose di 2,5 mg/giorno (1,25 mg alle 14:00 e alle 21:00). I retinoidi: Acido trans retinoico, palpitato di vitamina A e betacarotene furono somministrati oralmente, alle 8:00 in 5 ml di vitamina E, rispettivamente in dosi di 5 mg, 5000 UI e 20 mg/giorno. La melatonina fu somministrata oralmente ad una dose di 20 mg/giorno (10 mg alle 14:00 e alle 21:00). L'ACTH fu somministrato intra muscolo ad una dose di 1 mg/settimana.
Tutti i pazienti furono trattati per almeno 1 mese. Alla fine di questo periodo, quelli che avevano una malattia stabile o una parziale risposta ricevettero altri due mesi di trattamento, e quelli che risposero dopo tre mesi furono trattati per tre mesi e più.
Criteri per la risposta
Una risposta completa o remissione fu definita come la completa regressione di tutte le lesioni linfomatose misurabili. Una risposta parziale fu definita come una riduzione >=50% nella somma dei prodotti dei due diametri (il diametro più lungo e quello ad esso perpendicolare) di una o più lesioni durate almeno 4 settimane.
La progressione fu definita dall'aumento nel volume delle lesioni preesistenti di almeno il 25%, l'insorgere di nuove lesioni o l'aumento della milza e del fegato di almeno 2 centimetri dovuto al linfoma. Quei pazienti che non potevano essere chiaramente collocati nelle categorie descritte venivano definiti in condizioni stabili. La valutazione della risposta fu fatta a 1 mese dall'inizio del trattamento. La valutazione fu portata avanti dopo altri due mesi e, più tardi, dopo 3 mesi nei pazienti che continuarono il trattamento.
RISULTATI
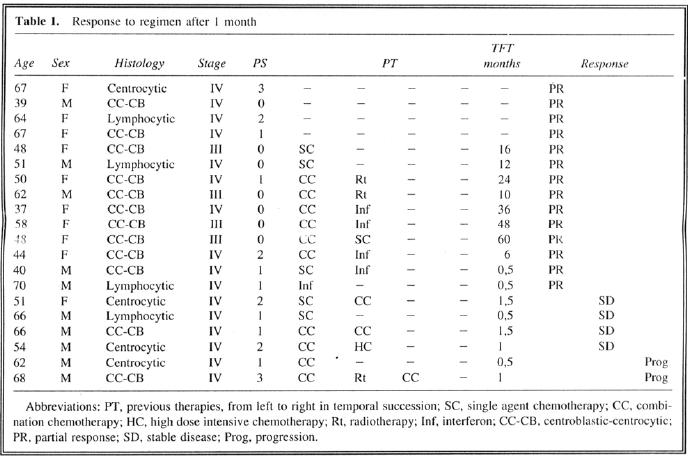
Venti pazienti (dieci uomini e dieci donne tra i 37 e i 70 anni) con istiologia di basso grado furono inclusi in questo studio, e furono tutti valutati per tossicità e risposta. Il 60% (12 su 20) ebbero istiologia centrocitica-centroblastica e 10 erano stati trattati in precedenza. Il 20% (4 di 20) ebbero istiologia centrocitica, il rimanente 20% ebbe istiologia linfocitica e 3 di 4 in entrambi i gruppi erano stati trattati prima di questo studio. L'8% dei pazienti (16 di 20) erano in uno stadio IV e 20% (4 di 20) erano in stadio III. Il 50% (8 su 16) dei pazienti trattati in precedenza ebbero un periodo in cui non ricevettero la terapia (TFT)>=6 mesi e furono in recidiva; il 50% (8 su 16), con TFT<=1.5 mesi, ebbe una progressione durante la terapia seguita prima di entrare in questo studio. I risultati del trattamento dopo un mese sono descritti analiticamente nella Tabella 1.
Volume 16, Number 2, 2001 Mary Ann Liebert, Inc.
Ciclofosfamide più somatostatina, bromocriptina, retinoidi, melatonina e ACTH nel trattamento dei linfomi non-Hodgkin di basso grado in stadio avanzato: risultati di una sperimentazione di fase II.
Mauro Todisco, MD, Piergiorgio Casaccia, MD e Nazzareno Rossi, ASL 13 in Sondrio e ASL 106 in Teramo.
Scopo:
E' stato dimostrato che la somatostatina, la prolattina, i retinoidi, la melatonina e l'ACTH influenzano la crescita linfatica, e l'azione del ciclofosfamide nei disordini linfoproliferativi è ben nota. Questo fornì le basi per condurre, in pazienti con linfomi non-Hodgkin di basso grado (NHL), una sperimentazione di fase II di un'associazione combinata di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH.
Pazienti e metodi
Venti pazienti con una diagnosi di NHL di basso grado, di stadio III o IV, furono inclusi in questo studio. I pazienti ricevettero per un mese il seguente trattamento: ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH. La terapia fu continuata per altri due mesi in pazienti con malattia stabile e rispondente. Dopo tre mesi, i pazienti che rispondevano alla terapia la continuarono per tre mesi e più. Risultati Venti pazienti furono valutabili per tossicità e risposta; 70% (14 di 20 pazienti; 95% di intervallo di confidenza [CI], da 50% a 90%) ebbero una parziale risposta; il 20% (4 su 20) ebbero una malattia stabile, e il 10% (2 su 20) progredirono con la terapia. Continuando con la terapia, nessuno dei 14 pazienti con una risposta parziale ebbe una progressione della malattia (tempo di controllo medio di 21 mesi, gamma, da 7 a 25), e il 50% di questi pazienti ebbe una completa risposta e il 75% (3 di 4) progredirono con la terapia (tempo medio di progressione [TTO] 14.3 mesi, gamma, da 7 a 21). La tossicità era molto modesta, gli effetti collaterali più comuni furono: sonnolenza, diarrea e iperglicemia. Conclusioni L'associazione di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH è ben tollerata ed efficace nel trattamento del NHL di basso grado ad uno stadio avanzato.
INTRODUZIONE
Di recente è stato dimostrato che nuovi agenti inibiscono la crescita linfatica. Tra questi, soprattutto quelli senza tossicità per il midollo osseo, come la somatostatina, suscitarono grande interesse per la possibilità di utilizzarli con regimi di chemioterapia mielosoppressivi senza determinare un ulteriore mielosoppressione. Un'associazione come questa fu proposta per la prima volta nel 1979 da Di Bella e altri, che utilizzarono il ciclofosfamide insieme con la somatostatina, la bromocriptina, i retinoidi, la melatonina e l'ACTH in diversi tipi di cancro, inclusi i linfoma non-Hodgkin (NHL). Sulla base di questa associazione farmacologica, in particolare dell'uso della somatostatina e della bromocriptina, esiste l'assunto, formulato da Di Bella, che l'ormone della crescita (GH) e la prolattina sono coinvolti nella crescita neoplastica. Tale assunto, nella leucemia linfoblastica acuta, fu formulato anche da altri autori, nello stesso periodo, anche se solo per il GH. Successivamente, Payan e altri limostrarono che la somatostatina inibisce la crescita di linfociti umani primari in coltura e di cellule Molt-4; Nakamura e altri identificarono i recettori della somatostatina sulla membrana di diverse linee di cellule linfoidi e Hiruma e altri scoprirono i recettori della somatostatina sulle cellule umane di leucemia primaria. Inoltre, fu dimostrato che la maggior parte delle lesioni linfomatose sono identificabili con gli analoghi radiomarcati della somatostatina. In accordo con i risultati sopra menzionati, Witzig e altri nel 1995 affermarono che l'octreotide, un analogo della somatostatina, mostra attività in pazienti con il NHL di basso grado. L'influenza sulla crescita linfatica è stata anche dimostrata per la prolattina, i retinoidi, la melatonina e l'ACTH. È stato dimostrato che la prolattina stimola la crescita dei linfomi sperimentali, sia in vivo che in vitro, e i recettori della prolattina sono presenti sulla superficie delle cellule linfoidi neoplastiche e normali. Matera e altri dimostrarono che la prolattina è una fattore di crescita autocrino per una linea di cellule leucemiche umane, e Hooghe e altri ritornarono all'ipotesi, già sostenuta da Di Bella, che la prolattina e il GH hanno un ruolo importante nel linfoma e nella leucemia. In ematologia, l'effetto antitumorale dei retinoidi è basato su diverse prove dell'effetto dell'acido trans retinoico nella leucemia promielocitica, nel linfoma delle cellule T localizzato nella pelle e anche nei linfomi delle cellule B. La melatonina inibisce l'incorporazione di timidina nei normali linfociti e nelle linee di cellule linfoblastoidi e inibisce la risposta proliferativa ai fitogeni. Inoltre la melatonina porta avanti un azione antimielodisplastica e diminuisce la tossicità per il midollo osseo degli agenti chemioterapici. E' stato dimostrato che i linfociti T e B presentano il recettore dell'ACTH sulla superficie delle loro cellule; inoltre l'ACTH abbassa la blastogenesi dei linfociti in risposta alla fitoemaglutinina e alla concanavallin A e ha un ruolo nella modulazione dell'attività delle cellule NK. Questi studi, insieme alla ben nota azione del ciclofosfamide, fornirono la base per disegnare uno studio di fase II per determinare se una terapia combinata di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH ha un'attività in pazienti con il NHL di basso grado in stadio avanzato.
PAZIENTI E METODI
Selezione dei pazienti
I pazienti furono selezionati sulla base di una diagnosi clinica di NHL di basso grado, stadio III o IV. Criteri addizionali di selezione furono: uno stato di esecuzione (PS) tra 0 e 3, secondo l'Eastern Cooperative Oncology Group, e la presenza di lesione misurabile bidimensionalmente, come dimostrato dall'esame fisico, dalla radiografia del torace, dall'ecotomografia, dalla tomografia computerizzata o risonanza magnetica.
I pazienti che avevano ricevuto altri trattamenti furono inclusi in questo studio solo se il primo trattamento non era stato efficace. Ai pazienti che ricevevano la chemioterapia fu chiesto di sospendere la somministrazione di qualunque farmaco per almeno 15 giorni prima di iniziare la terapia combinata. La tossicità fu valutata usando criteri sviluppati dall'Organizzazione Mondiale per la Sanità. Trattamento I pazienti ricevettero una combinazione di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH. Il ciclofosfamide fu somministrato oralmente ad una dose di 75 mg/giorno (50 mg alle 14:00 e 25 alle 21:00). La somatostatina fu somministrata sottocute (SQ) ad una dose di 1,5 mg/giorno entro 8 ore usando una siringa a pompa. La somministrazione iniziò almeno tre ore dopo la cena e quei pazienti che erano psicologicamente incapaci di accettare questo tipo di somministrazione ricevettero una singola iniezione SQ di octreotide (0,5 mg/giorno) tre ore dopo la cena.
La bromocriptina fu somministrata oralmente ad una dose di 2,5 mg/giorno (1,25 mg alle 14:00 e alle 21:00). I retinoidi: Acido trans retinoico, palpitato di vitamina A e betacarotene furono somministrati oralmente, alle 8:00 in 5 ml di vitamina E, rispettivamente in dosi di 5 mg, 5000 UI e 20 mg/giorno. La melatonina fu somministrata oralmente ad una dose di 20 mg/giorno (10 mg alle 14:00 e alle 21:00). L'ACTH fu somministrato intra muscolo ad una dose di 1 mg/settimana.
Tutti i pazienti furono trattati per almeno 1 mese. Alla fine di questo periodo, quelli che avevano una malattia stabile o una parziale risposta ricevettero altri due mesi di trattamento, e quelli che risposero dopo tre mesi furono trattati per tre mesi e più.
Criteri per la risposta
Una risposta completa o remissione fu definita come la completa regressione di tutte le lesioni linfomatose misurabili. Una risposta parziale fu definita come una riduzione >=50% nella somma dei prodotti dei due diametri (il diametro più lungo e quello ad esso perpendicolare) di una o più lesioni durate almeno 4 settimane.
La progressione fu definita dall'aumento nel volume delle lesioni preesistenti di almeno il 25%, l'insorgere di nuove lesioni o l'aumento della milza e del fegato di almeno 2 centimetri dovuto al linfoma. Quei pazienti che non potevano essere chiaramente collocati nelle categorie descritte venivano definiti in condizioni stabili. La valutazione della risposta fu fatta a 1 mese dall'inizio del trattamento. La valutazione fu portata avanti dopo altri due mesi e, più tardi, dopo 3 mesi nei pazienti che continuarono il trattamento.
RISULTATI
Venti pazienti (dieci uomini e dieci donne tra i 37 e i 70 anni) con istiologia di basso grado furono inclusi in questo studio, e furono tutti valutati per tossicità e risposta. Il 60% (12 su 20) ebbero istiologia centrocitica-centroblastica e 10 erano stati trattati in precedenza. Il 20% (4 di 20) ebbero istiologia centrocitica, il rimanente 20% ebbe istiologia linfocitica e 3 di 4 in entrambi i gruppi erano stati trattati prima di questo studio. L'8% dei pazienti (16 di 20) erano in uno stadio IV e 20% (4 di 20) erano in stadio III. Il 50% (8 su 16) dei pazienti trattati in precedenza ebbero un periodo in cui non ricevettero la terapia (TFT)>=6 mesi e furono in recidiva; il 50% (8 su 16), con TFT<=1.5 mesi, ebbe una progressione durante la terapia seguita prima di entrare in questo studio. I risultati del trattamento dopo un mese sono descritti analiticamente nella Tabella 1.
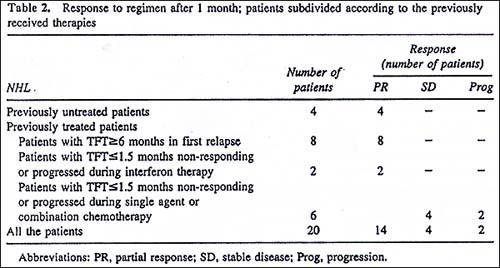
Il 70% dei pazienti (14 su 20; 95% CI, da 50 a 90%) ebbero una parziale risposta; il 20% (4 su 20; 95% CI, da 2.5% a 37.5%) ebbero una malattia stabile e il 10% (2 su 20) progredirono nella terapia. La risposta dopo un mese nei pazienti suddivisi secondo le terapie ricevute in precedenza è descritto nella Tabella 2.
Il 100% (4 su 4) dei pazienti non trattati in precedenza, 100% (8 su 8) dei pazienti con TFT>= 6 mesi e il 100% dei pazienti con TFT>=1.5 che non risposero o progredirono durante la terapia d'interferone, ebbero una parziale risposta. Tra i pazienti con TFT <=1.5 mesi che non risposero o progredirono durante la chemioterapia con un singolo agente o combinata, il 66.6% (4 su 6; 95% CI, da 28% a 104%) ebbero una malattia stabile e il 33.3% (2 su 6) progredirono. La risposta alla continuazione del trattamento è descritta analiticamente nella Tabella 3.
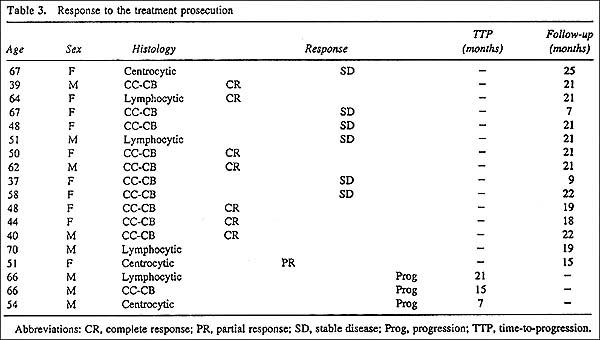
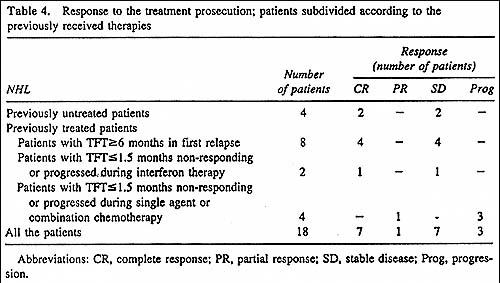
Tra i 14 pazienti che dopo un mese ebbero una risposta parziale, non ci fu progressione della malattia (tempo medio di controllo di 21 mesi, gamma, da 7 a 25), e il 50% di questi pazienti (7 su 14; 95% CI, da 24% a76%) ottennero una completa risposta. Tra i 4 pazienti che dopo un mese ebbero una malattia stabile, il 25% (1 su 4) ebbero una risposta parziale e il 75% (3 su 4) progredirono (tempo medio di progressione 14.3 mesi, gamma, da 7 a 21). La risposta al proseguimento del trattamento nei pazienti suddivisi secondo le terapie ricevute in precedenza è descritta nella Tabella 4.
Tutti i 20 pazienti furono valutabili per la tossicità. Gli effetti collaterali più comuni furono segni gastrointestinali. 1125% dei casi ebbe diarrea di primo grado (2 pazienti) o secondo grado (3 pazienti); il 20% (4 pazienti) ebbero nausea o vomito di grado 1, e 5 pazienti ebbero perdita di appetito o anoressia. Questi effetti collaterali non richiesero la sospensione della terapia ma solo un aggiustamento della dose di somatostatina. Sonnolenza fu osservata nel 20% (4 su 20) dei pazienti e richiese un aggiustamento del programma giornaliero della somministrazione della melatonina (20 mg/al giorno furono suddivisi in tre dosi, invece che due, una delle quali prima di andare a dormire). Il 25% dei pazienti (5 su 20) ebbe iperglicemia di grado 1 (<=160/dL) e il 20% (4 su 20 ) ebbe edema della caviglia e/o della faccia. In entrambi questi casi la dose di ACTH fu ridotta a 0.5 mg/settimana.
DISCUSSIONE
Le NHL di basso grado in stadio avanzato sono ancora malattie incurabili, il cui trattamento, proprio a causa di questi limiti terapeutici, è molto discusso, dato che coesistono la chemioterapia con un singolo agente, la chemioterapia combinata, una combinazione di radioterapia e chemioterapia, la chemioterapia intensiva con dosi massicce con trapianto di midollo osseo autologo o trapianto di cellule progenitrici autologhe. In questo studio abbiamo valutato la tossicità ed efficacia di un regime, noto come multiterapia Di Bella (DBM), che è un'associazione di un agente chemioterapico, il ciclofosfamide, con altre sostanze non mielosoppressive (somatostatina, bromocriptina, retinoidi, melatonina e ACTH). I risultati che abbiamo ottenuto - 70% di risposta parziale dopo 1 mese, il 50% dei quali rispose completamente continuando il trattamento - sono stati nettamente migliori rispetto a quelli descritti con un singolo agente chemioterapico con alkylants, con il quale Kimby e altri descrissero il 36% di risposta totale con una risposta completa nel 5% di 132 pazienti trattati in precedenza, o rispetto a quelli descritti da Witzig e altri con la somatostatina come unico agente (36% di risposta parziale in 28 pazienti trattati e non in precedenza). Ciò dimostra la superiorità terapeutica di una tale associazione farmacologia rispetto ai suoi singoli costituenti. Inoltre, l'attività del regime dipendeva dal tipo di terapia precedente e dal TFT. Abbiamo documentato il 100% di risposta globale tra i pazienti non trattati in precedenza, i pazienti in prima recidiva con TFT>= a 6 mesi e i pazienti con TFT <= 1.5 che non avevano risposto o erano progrediti durante la terapia d'interferone. Questo risultato, migliore di altri ottenuti con regimi di chemioterapia ampiamente utilizzati [Kimby e altri descrissero il 60% di risposta globale con CHOP in 127 pazienti non trattati in precedenza con NHL di basso grado in stadio III e IV], e l'ottima tolleranza del DBM (tutti i pazienti continuarono il trattamento a casa, continuando le loro normali attività), suggeriscono ulteriori esperimenti clinici usando questo regime in NHL. Con riferimento a tutto questo, la recente disponibilità di formule di deposito di somatostatina possono permettere una migliore applicabilità di questo regime, nel quale il principale problema era la somministrazione SQ giornaliera di somatostatina, soprattutto se effettuata con una siringa a pompa.
REFERENCES
1. Di Bella L, Rossi MT, Scalera O. Perspectives in pineal functions. Prog Brain Res 1979;52:475-8.
2. Rogers PC, Komp D, Rogol A, Sabio H. Possible effects of growth hormone on development of acute lymphoblastic leukaemia. Lancet 1977;2:434-5.
3. Payan DG, Hess CA, Goetzl EJ. lnhibition by somatostatin of the proliferation of Tlymphocytes and Molt-4 lymphoblasts. Cell Immunol 1984;84:433-8.
4. Nakarnura H, Koike T, Hiruma K, Sato T, Tomioka H, Yoshida S. Identification of lyrnphoid cell lines bearing receptors for somatostatin. Immunology 1987;62:655-8.
5. Hiruma K, Koike T, Nakamura H, Sumida T, Maeda T, Tomioka H, Yoshida S, Fujita T. Somatostatin receptors on human lymphocytes and leukaemia cells. Immunology 1990;71:480-5.
6. Krenning EP, Kwekkeboom DJ, Reubi JC, Van Hagen PM, van Eijck CH, Oei HY, Lamberts SW. In-111-octreotide scintigrapby in oncology. Metabolism 1992;41 (9 Suppl 2):83-6.
7. Reubi JC, Waser B, van Hagen M, Lamberts SW, Krenning EP, Gebbers JO, Laissue JA. In vitro and in vivo detection of somatostatin receptors in human malignant lymphornas. Int J Canc 1992;50:895-900.
8. Reubi JC, Waser 8, Horisberger U, Krenning E, Lamberts SW, Gebbers JO, Gersbach P, Laissue JA. In vitro autoradiographic and in vivo scintigraphic localisation of somatostatin receptors in human lymphatic tissue. Blood 1993; 82:2143-51.
9. Bares R, Galonska P, Dempke W, Handt S, Bull U, Osieka R. Somatostatin receptor scintigraphy in malignant lymphoma: first results and comparison with glucose rnetabolism measured by positron emission tomography. Horm Metab Res 1993;27:56-8.
10. Rettenbacher L, Galvan O. Differentiation between residual cancer and thymic hyperplasia in malignant non Hodgkin’s lymphoma with somatostatin receptor scintigraphy. Clin Nucl Med 1994;19:64-5.
11. Witzig TE, Letendre L, Gerstner I, Schroeder O, Mailliard JA, Colon-Otero G, MarschKe RF, Windschill HE. Evaluation of a somatostatin analog in the treatment of lymphoproliferative disorders: results of a phase II North Central Cancer Treatment Group Trial. J Clin Oncol 1995;13:2012-5.
12. Friesen HG, Shiu RP, Elsholtz H, Simpson S, Hughes J. Prolactin and growth hormone receptors. Ciba Found Symp 1982;90:263-78.
13. Shiu RP, Elsholtz HP, Tanaka T, Friesen HG, Gout PW, Beer CT, Noble RL. Receptormediated mitogenic action of prolactin in a rat lymphoma cell line. Endocrinology 1983; 113:159-65.
14. O’Neal KD, Schwarz LA, Yu-Lee LY. Prolactin receptor gene expression in lymphoid cells. Moll Cell Endocrinol 1991 ;82: 127-35.
15. Hooghe R, Delhase M, Vergani P. Malur A. Hooghe-Peters EL. Growth hormone and prolactin are paracrine growth and differentiation factors in the haemopoietic system. Immunol Today 1993; 14:212-214.
16. Leite De Moraes MC, Touraine P, Gagnerault MC, Savino W, Kelly PA, Dardenne M. Prolactin receptors and the immune system. Ann Endocrinol (Paris) 1995 ;56:567-70.
17. Matera L, Cutufia M, Geuna M, Conlarini M. Buttiglieri S, Galin S, Fazzari A, Cavaliere C. Prolactin is an autocrine growth factor for the Jurkat human T-leukemic cell line. J Neuroimmunol 1997;79: 12-21.
18. Hooghe R, Merchav S, Gaidano G, Naessens F, Matera L. A role for growth hormone and prolactin in leukaemia and lymphoma? Cell Mol Life Sci 1998;54: 1095-101.
19. Sacchi S, Russo D, Avvisati G, Dastoli G, Lazzarino M, Pelicci PG, Bonora MR, Visani G, Grassi C, Iacona I, Luzzi L, Vanzanelli P. All-trans retinoic acid in haematological malignancies, un update. GER (Gruppo Ematologico Retinoidi). Haematologica 1997; 82:106-21.
20. Kessler JF, Meyskens FL Jr, Levine N, Lynch PJ, Jones SE. Treatment of cutaneous T-cell lymphoma (mycosis fungoides) with 13-cis-retinoic acid. Lancet 1983;I: 1345-7.
21. Neely SM, Mehlmauer M, Feinstein DI. The effect of isotretinoin in six patients with cutaneous T-cell lymphoma. Arch lntern Med 1987;147:529-31.
22. Mahrle G, Thiele B. Retinoids in cutaneous T cell lymphomas. Dermatologica 1987; 175 (Suppl I): 145-50.
23. Zachariae H, Thestrup-Pedersen K. Interferon alpha and etretinate combination treatment of cutaneous T-cell lymphoma. J Invest Dermatol 1990:95(6 Suppl):206-8. 24. Chow JM, Cheng AL, Su IJ, Wang CH. 13-cis-retinoic acid induces cellular differentiation and durable remission in refractory cutaneous Ki-1 lymphoma. Cancer 1991;67:2490-4.
25. Su IJ, Cheng AL, Tsai TF, Lay JD. Retinoic acid-induced apoptosis and regression of a refractory Epstein-Barr virus-containing T cell lymphoma expressing multidrug-resistance phenotypes. Br J Haematol 1993; 85: 826-8.
26. Chou WC, Su IJ, Tien HF, Liang DC, Wang CH, Chang YC, Cheng AL. Clinicopathologic, cytogenetic, and molecular studies of 13 Chinese patients with Ki-1 anaplastic large cell lymphoma. Special emphasis in the tumor response to 13-cis retinoic acid. Cancer 1996;78: 1805-12.
27. Turley JM, Funakoshi S, Ruscetti FW, Kasper J, Murphy WJ, Longo DL, Birchenall-Roberts MC. Growth inhibition and apoptosis of RL human B lymphoma cells by vitamin E succinate and retinoic acid: role for transforming growth factor beta. Cell Growth Differ 1995; 6:655-63.
28. Cheng AL, Chuang SE, Su IJ. Factors associated with the therapeutic efficacy of retinoic acids on malignant lymphomas. J Formos Med Assoc 1997;96:525-34. 29. Sundaresan A, Claypool K, Mehta K, Lopez-Berestein G, Cabanillas F, Ford RJ Jr. Retinoidrnediated inhibition of cell growth with stimulation of apoptosis in aggressive B-cell lymphomas. Cell Growth Differ 1997;8: 107 1-82.
30. Persengiev SP, Kyurkchiev S. Selective effect of the proliferation of lymphoid cells. Int J Biochem, 1993; 25:441-4.
31. Konakchieva R, Kyurkchiev S, Kehayov I, Taushanova P, Kanchev L. Selective effect of methoxyndoles on the lymphocyte proliferation and melatonin binding to activated human lymphoid cells. J Neuroimmunol 1995; 63: 125-32.
32. Vijayalaxmi, Reiter RJ, Leal BZ, Meltz ML Effect of melatonin on mitotic and proliferation indices, and sister chromatid exchange in human blood lymphocytes. Mutat Res 1996;351:187-92.
33. Viviani S, Negretti E. Orazi A, Sozzi G, Santoro A, Lissoni P, Esposti O, Fraschini F. Preliminary studies on melatonin in the treatment of myelodislastic syndromes following cancer chemotherapy. J Pineal Res 1990; 8:347-54.
34. Rapozzi V, Zorzet S, Comelli M, Mavelli I, Perissin L, Giraldi T. Melatonin decreases bone marrow and lymphatic toxicity of adriamicin in mice bearing TLX5 lymphoma. Life Sci 1998;63: 1701-13.
35. Clarke BL. Bost KL. Differential expression of functional adrenocorticotropic hormone receptors by subpopulations of lymphocytes. J Immunol 1989;143:464- 469. 36. Roth JA, Kaeberle ML, Hsu WH. Effects of ACTH administration on bovine polymorphonuclear leukocyte function and lymphocyte blastogenesis. Am J Vet Res 1982 ;43:4 12-4 16.
37. Gatti O, Masera RG, Pallavicini L, Sartori ML. Staurenghi A, Orlandi F, Angeli A. Interplay in vitro between ACTH, beta-endorphin, and glucocorticoids in the modulation of spontaneous and lymphokine-inducible human natural killer (NK) cell activity. Brain Behav Immun 1993;7:16-28.
38. Kimby E, Bjorkholm M, Gahrton G, Glimelius B, Hagberg H, Johansson B, Johansson H, Juliusson G, Jarnmark M, Lofvenberg E. Chlorambucil/prednisone vs. CHOP in symptomatic low-grade non Hodgkin’s lymphomas: a randomized trial from the Lymphoma Group of Central Sweden. Ann Oncol 1994;5 (Suppl 2):67-71.