Carcinoma plurifocale della mammella
Pubblicato il 15/09/2014
TITOLO
Risposta obiettiva completa a terapia biologica di carcinoma plurifocale della mammella
Autore
Dr. Giuseppe Di Bella
Ente o istituzione di appartenenza
Fondazione Di Bella
Indirizzo per corrispondenza
e-mail posta@giuseppedibella.it
Telefono 051 239662 ;- 051 230369 ; - Fax 051 2961238
Indirizzo postale Via Marconi N°51 CAP 40122 Bologna - Italia
Parole chiave: carcinoma mammella; induzione di remissione; terapia biologica; breast carcinoma; remission induction; biological therapy; 2
ABSTRACT
In una donna con carcinoma della mammella, la cura biologica del Prof. L. Di Bella (MDB) in sette mesi ha prodotto una risposta obiettiva parziale del 50%, e totale in 14 mesi, estesa alle adenopatie ascellari bilaterali, senza tossicità.
Il MDB prevede molecole antiproliferative, come somatostatina, inibitori prolattinici ed estrogenici insieme a molecole differenzianti e apoptotiche come MLT, Retinoidi, Vitamina E, D3, Vita C, Calcio, Aminozuccheri, associate a dosi minime di chemioterapici.
Gli esami ematochimici non hanno evidenziato danni, ma una progressiva riduzione della Prolattina, Estradiolo, IGF1, e il mantenimento di bassi livelli di GH.
Il risultato obiettivo, in assenza di tossicità, di questo caso evidenzia l’efficacia di questa terapia ed è conforme ai positivi risultati già pubblicati sull’uso del MDB nei LNH a basso grado e carcinomi polmonari al 3° e 4° stadio.
Il MDB, senza necessità di ricovero o day hospital, in assenza di tossicità, e senza ridurre minimamente l’attività lavorativa, ha evitato il trauma chirurgico e i rilevanti effetti collaterali di chemio e radioterapia.
L’applicazione precoce del MDB come terapia di prima linea, in un organismo non debilitato dagli effetti tossici mutageni e immunodepressivi della chemio– radioterapia, ha grandemente facilitato il risultato.
Riteniamo utile segnalare il caso per invitare ad un maggiore interesse, studio e approfondimento sulle possibilità aperte in oncologia dalla terapia biologica e recettoriale MDB
Il MDB prevede molecole antiproliferative, come somatostatina, inibitori prolattinici ed estrogenici insieme a molecole differenzianti e apoptotiche come MLT, Retinoidi, Vitamina E, D3, Vita C, Calcio, Aminozuccheri, associate a dosi minime di chemioterapici.
Gli esami ematochimici non hanno evidenziato danni, ma una progressiva riduzione della Prolattina, Estradiolo, IGF1, e il mantenimento di bassi livelli di GH.
Il risultato obiettivo, in assenza di tossicità, di questo caso evidenzia l’efficacia di questa terapia ed è conforme ai positivi risultati già pubblicati sull’uso del MDB nei LNH a basso grado e carcinomi polmonari al 3° e 4° stadio.
Il MDB, senza necessità di ricovero o day hospital, in assenza di tossicità, e senza ridurre minimamente l’attività lavorativa, ha evitato il trauma chirurgico e i rilevanti effetti collaterali di chemio e radioterapia.
L’applicazione precoce del MDB come terapia di prima linea, in un organismo non debilitato dagli effetti tossici mutageni e immunodepressivi della chemio– radioterapia, ha grandemente facilitato il risultato.
Riteniamo utile segnalare il caso per invitare ad un maggiore interesse, studio e approfondimento sulle possibilità aperte in oncologia dalla terapia biologica e recettoriale MDB
INTRODUZIONE
Si presenta un caso di remissione completa (RC) con terapia biologica (MDB) di un carcinoma mammario multifocale in una donna, con 3 localizzazioni nella mammella SN, sia duttali che lobulari infiltranti, con alterazioni microfibrocistiche bilaterali, evidente linfoadenopatia ascellare reattiva bilaterale, e 2 piccole lesioni cerebrali, rilevate alla TAC con contrasto, di sospetta, ma non certa, natura metastatica.
Sono riportati i componenti della terapia biologica MDB (Metodo Di Bella) effettuata, gli esami istologici ed ematochimici, oltre a quelli strumentali, prima e dopo il trattamento MDB.
Si descrive in estrema sintesi il razionale del MDB, documentandone le basi scientifiche.
Sono riportati i componenti della terapia biologica MDB (Metodo Di Bella) effettuata, gli esami istologici ed ematochimici, oltre a quelli strumentali, prima e dopo il trattamento MDB.
Si descrive in estrema sintesi il razionale del MDB, documentandone le basi scientifiche.
CASO CLINICO
Paziente di 51 anni, Kg 62 – 2 figli, menarca a 11 anni, mestruazioni regolari, non mastodinia, aspetto capezzoli normale, dotti dilatati, secrezione assente – Per 6 anni pillola anticoncezionale estro–progestinica. Primi sintomi gennaio 06.
Diagnosi e terapia formulata dal “Centro Diagnostico Terapeutico per la mammella” - Istituto di Oncologia dell’Università di Ferrara – Italia, di cui si riporta il referto, basato su mammografia ed ecografie, riscontro istopatologico ed esame obiettivo: ““…Mastopatia microcistica macrocistica con alcune aree macrocistiche ed ectasia duttale, discreta componente adiposa prevalentemente preghiandolare Linfoadenopatia ascellare più pronunciata a SN senza evidente disorganizzazione architetturale.””
Sede : quadrante supero-interno SN
distanza dalla cute: 3,6 mm,
distanza dal capezzolo: 22 mm
contorni sfumati
ecogenicità bassa
strato adiposo sottocutaneo ridotto
età della comparsa del tumore: 51
distanza dalla fascia: 1,0 dimensioni (della maggiore delle 3 neoplasie) mm 13,8 x 15,7 x 11
margini della neoplasia finemente frastagliati
ecogenicità cutanea
normale strato adiposo retro ridotto
Processi proliferativi:
1) sul raggio delle ore 9 della mammella SN di mm 10 x 11x 9,7 a 3,6 mm dalla cute e a 2,6 mm dalla fascia, a 30 mm dal capezzolo
2) dal raggio delle ore 11 alle 11,30 di mm 13,6 x 11 x 15,7 del quadrante supero-interno della mammella SN
3) della linea emitelica superiore SN di mm 5,5 x 4,4 x 4,4
16/02/2006 - Viene eseguita agobiopsia delle lesioni 1) e 2), inviata per esame al Dipartimento di Patologia e Oncologia dell’Università di Ferrara, che formula la seguente diagnosi istopatologica :
1) “Carcinoma duttale infiltrante, coesiste propagazione pagetoide da carcinoma globulare in situ ai dotti”.
2) “Carcinoma duttale e lobulare infiltrante; coesiste carcinoma lobulare in situ”. Sei frustoli delle biopsie percutanee mammarie (Core Biopsy) sono stati inviati, per consulenza, anche all’Istituto di Anatomia Patologica dell’Università di Bologna – Ospedale Bellaria, cha ha così refertato : “Carcinoma duttale invasivo di grado 2°, associato a carcinoma in situ, probabilmente globulare (B5). mn ”
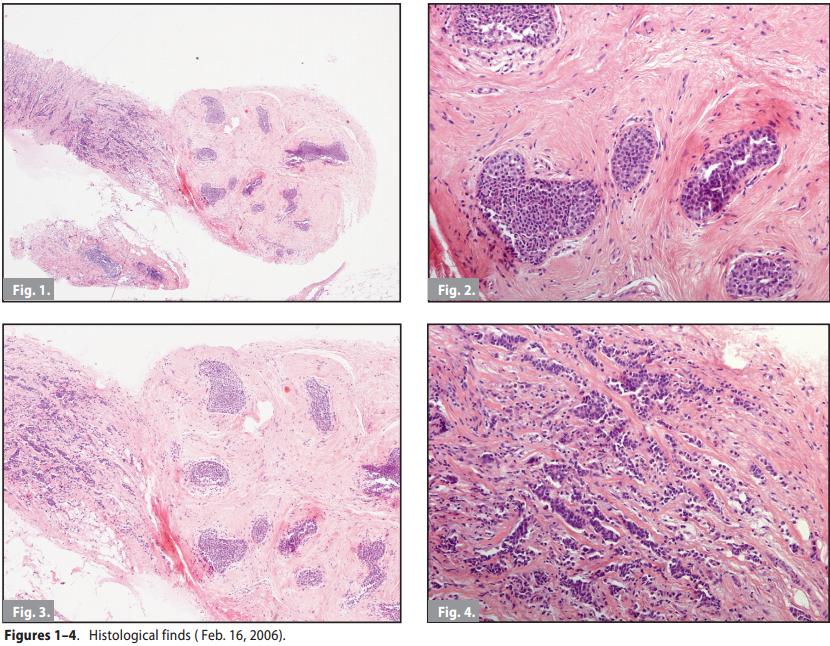
Ulteriori esami strumentali:
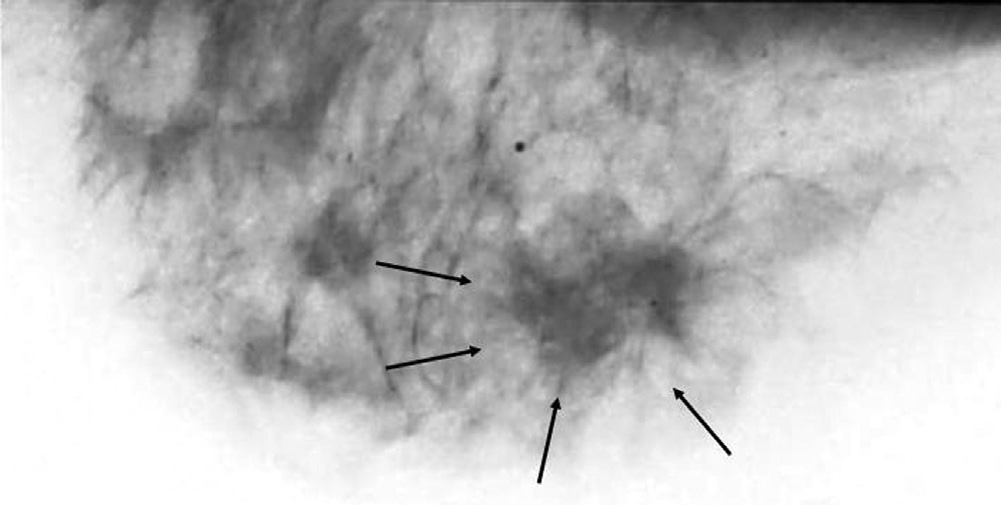
09/02/2006 RX (mammografia)
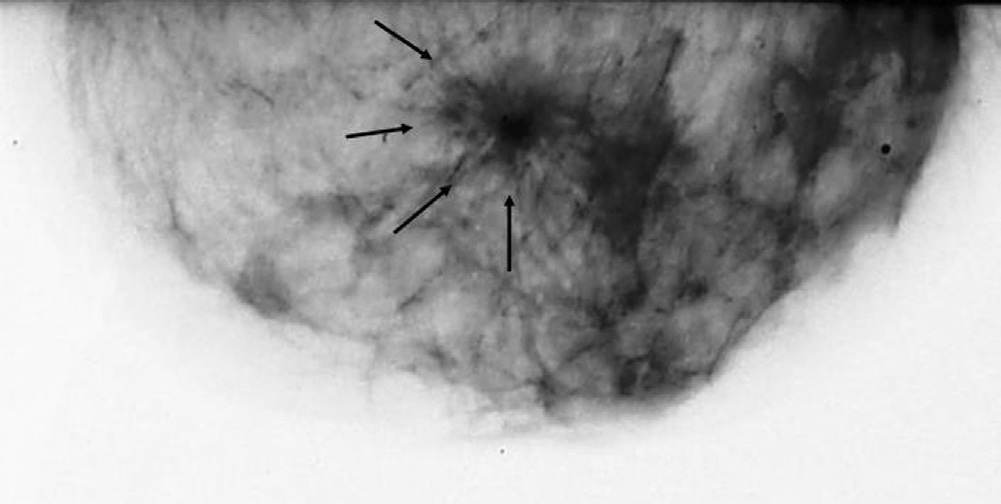
15|02|2006 Ecografia mammella
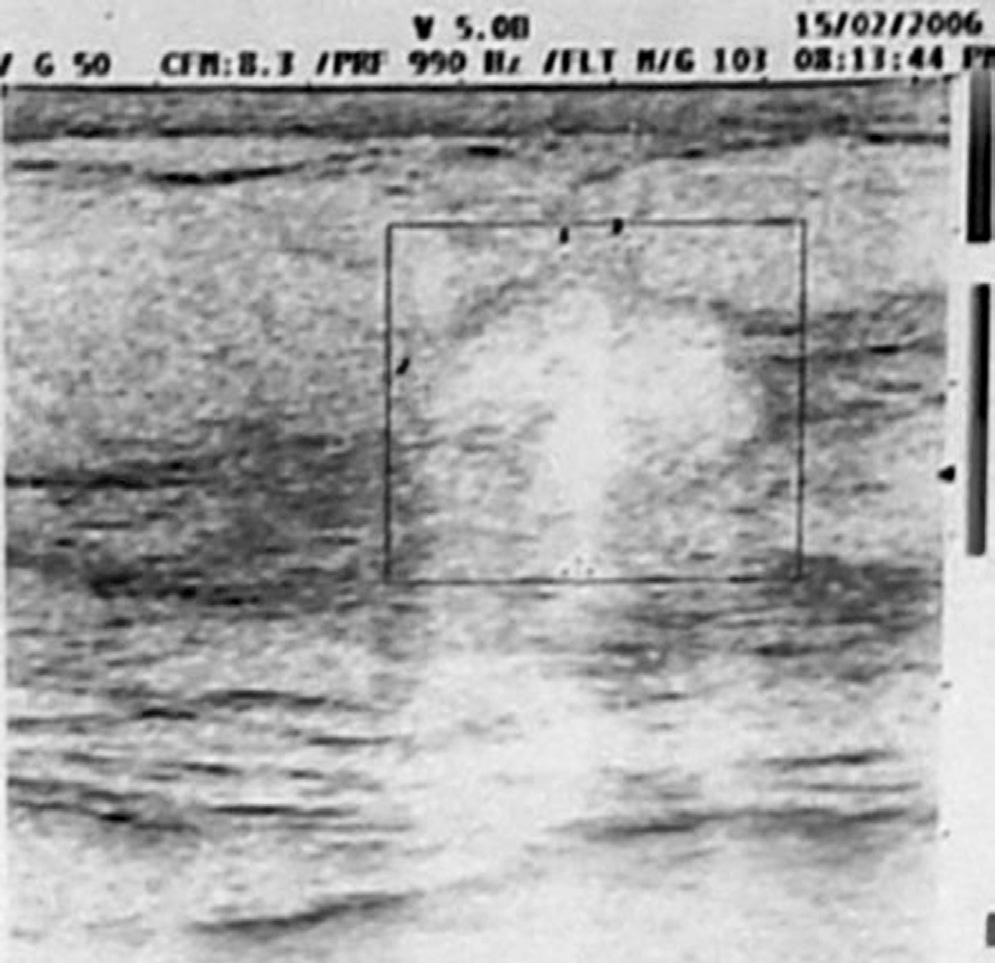
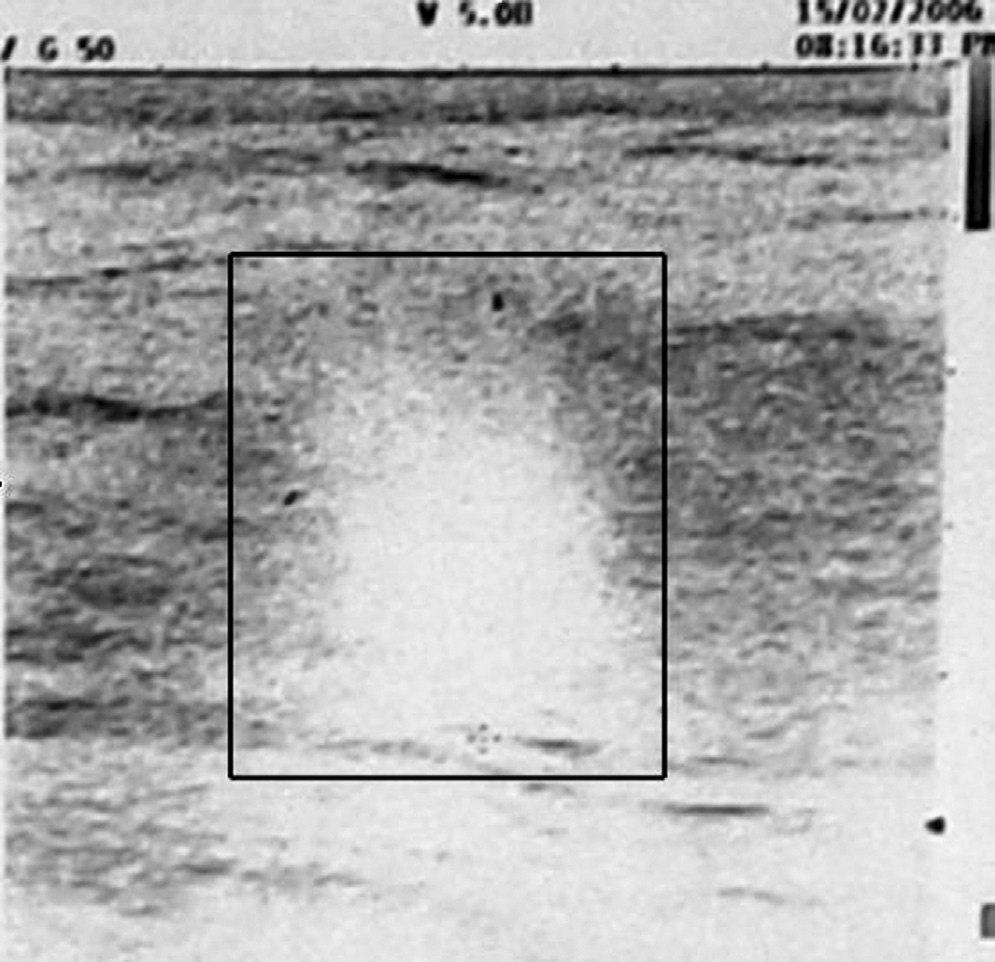
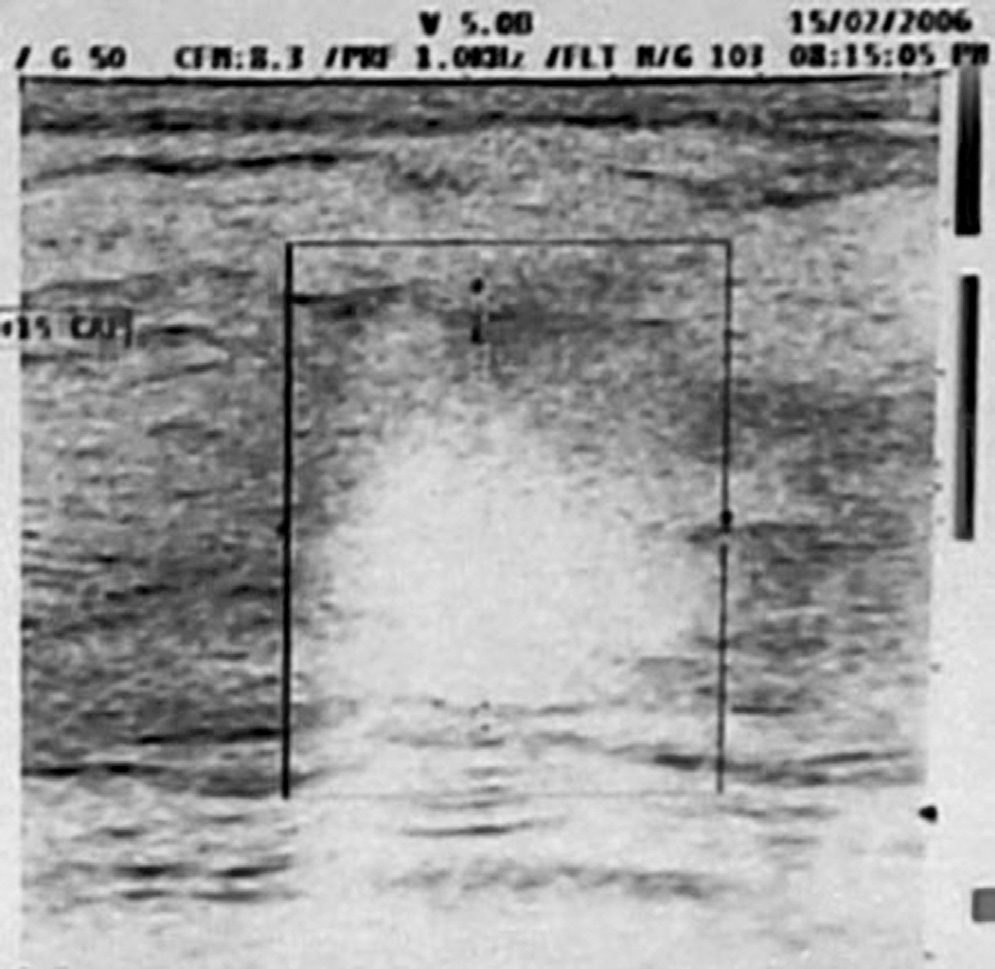
Conclusioni diagnostiche dell’Università di Ferrara:”Neoplasia mammaria SN (carcinoma duttale e globulare infiltrante), alterazioni cerebrali di non univoca interpretazione ”.
Terapia proposta: Mastectomia totale con svuotamento linfonodale ascellare seguita da radio-chemioterapia.
Alla fine della relazione clinica rilasciata alla paziente il 14/03/2006 a conclusione dell’iter diagnostico, si evidenzia e sottolinea: ”Si consiglia vivamente di non procrastinare l’intervento “
22/3/2006 — La Paziente, rifiutando l’intervento, inizia l’applicazione della terapia biologica del Prof. Luigi Di Bella (MDB)
Esami strumentali eseguiti durante il periodo di trattamento MDB
18/10/2006 - Dopo circa 7 mesi di cura MDB, l’ecografia evidenzia la scomparsa delle adenopatie ascellari bilaterali, di due delle 3 lesioni neoplastiche, e la riduzione a 9 mm della localizzazione tumorale residua.
Referto:“strutture ghiandolari disomogenee con piccole aree cistiche sparse e dotti ectasici nelle regioni areolari.
Nel settore supero interno di Sn, ad ore 11, area ipoecogena a contorni irregolari con asse maggiore di 9 mm.
Non altri elementi di sospetto, con l’eccezione di piccola zona di disordine architettonico nel settore inferomediale sn. Non adenopatie ascellari, sovraclaveari e, per quanto giudicabile, mammarie interne”.
14/12/2006 – Dopo 2 mesi, e a nove mesi dall’inizio del MDB, l’ecografia documenta ulteriore riduzione “” l’attuale indagine confrontata con la precedente del 7 febbraio 2006 dimostra che la formazione espansiva con caratteri infiltrativi già segnalata a carico della mammella sn alle ore 11,30 si è ridotta di dimensioni e attualmente misura circa 6 mm.
A dx non immagini patologiche. Si consigliano controlli eco-mammografici in considerazione della relativa densità della componente ghiandolare. “”
05/04/2007 - Ecografia : “” non alterazioni strutturali a carico della mammella dx.
A Sn al quadrante supero interno, in prossimità del piano sagittale mediano, tuttora riconoscibile l’area ipoecogena a margini sfumati gia indagata con agoaspirato, con attenuazione del fascio ultrasonoro delle dimensioni di 5,8 x 3,8 x 5,1 mm. Tale formazione dista col suo margine più superficiale ad un centimetro dal piano cutaneo e a circa 3 mm dalla fascia muscolare.
Non linfoadenopatie sospette in regione ascellare e sovraclaveare .“”
28/08/2007 - RM bilaterale con e senza mezzo di contrasto: “” Nelle sequenza T2 pesate nel contesto di entrambi i corpi ghiandolari, si riconoscono alcune minute formazioni cistiche.
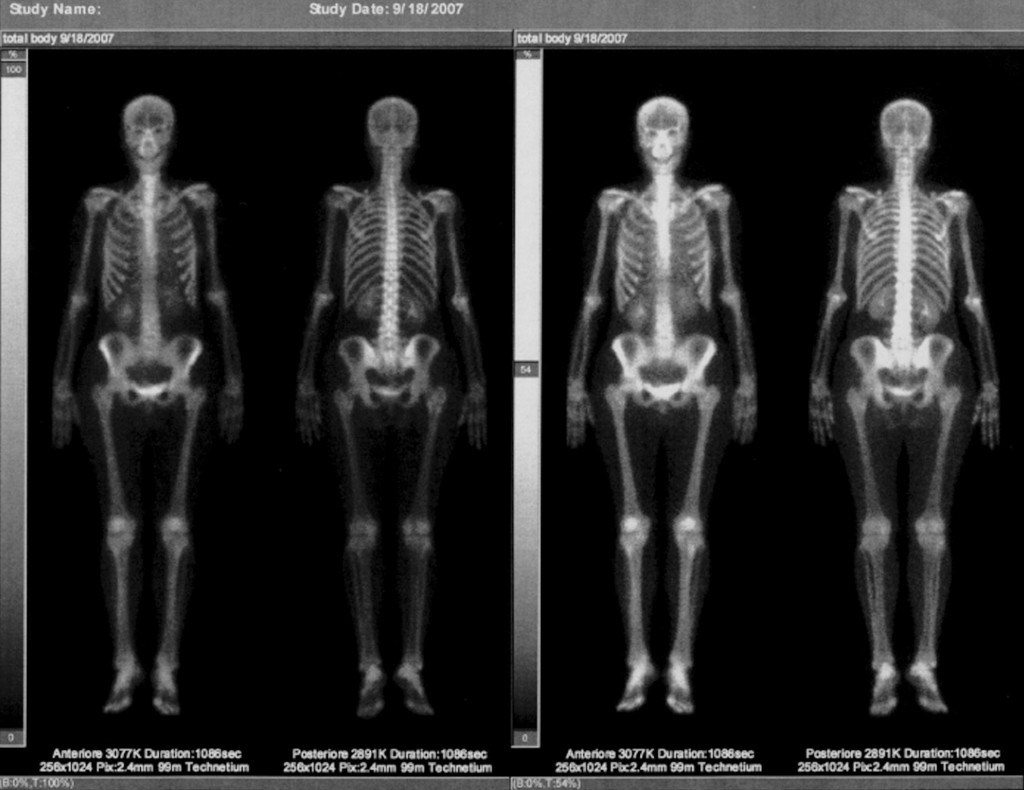
Dopo somministrazione di mezzo di contrasto, non si evidenziano aree con enhancement sospetto bilateralmente. In particolare non formazioni espansive in corrispondenza dell’area ipoecogena con sbarramento acustico posteriore precedentemente descritto all’indagine ecografica ”” 18/09/2007 - Scintigrafia ossea e articolare totale corporea: negativa
Referto:“strutture ghiandolari disomogenee con piccole aree cistiche sparse e dotti ectasici nelle regioni areolari.
Nel settore supero interno di Sn, ad ore 11, area ipoecogena a contorni irregolari con asse maggiore di 9 mm.
Non altri elementi di sospetto, con l’eccezione di piccola zona di disordine architettonico nel settore inferomediale sn. Non adenopatie ascellari, sovraclaveari e, per quanto giudicabile, mammarie interne”.
14/12/2006 – Dopo 2 mesi, e a nove mesi dall’inizio del MDB, l’ecografia documenta ulteriore riduzione “” l’attuale indagine confrontata con la precedente del 7 febbraio 2006 dimostra che la formazione espansiva con caratteri infiltrativi già segnalata a carico della mammella sn alle ore 11,30 si è ridotta di dimensioni e attualmente misura circa 6 mm.
A dx non immagini patologiche. Si consigliano controlli eco-mammografici in considerazione della relativa densità della componente ghiandolare. “”
05/04/2007 - Ecografia : “” non alterazioni strutturali a carico della mammella dx.
A Sn al quadrante supero interno, in prossimità del piano sagittale mediano, tuttora riconoscibile l’area ipoecogena a margini sfumati gia indagata con agoaspirato, con attenuazione del fascio ultrasonoro delle dimensioni di 5,8 x 3,8 x 5,1 mm. Tale formazione dista col suo margine più superficiale ad un centimetro dal piano cutaneo e a circa 3 mm dalla fascia muscolare.
Non linfoadenopatie sospette in regione ascellare e sovraclaveare .“”
28/08/2007 - RM bilaterale con e senza mezzo di contrasto: “” Nelle sequenza T2 pesate nel contesto di entrambi i corpi ghiandolari, si riconoscono alcune minute formazioni cistiche.
Dopo somministrazione di mezzo di contrasto, non si evidenziano aree con enhancement sospetto bilateralmente. In particolare non formazioni espansive in corrispondenza dell’area ipoecogena con sbarramento acustico posteriore precedentemente descritto all’indagine ecografica ”” 18/09/2007 - Scintigrafia ossea e articolare totale corporea: negativa
20/09/2007 - RX torace: negativo
20/09/2007 - Ecografia addominale completa : negativa
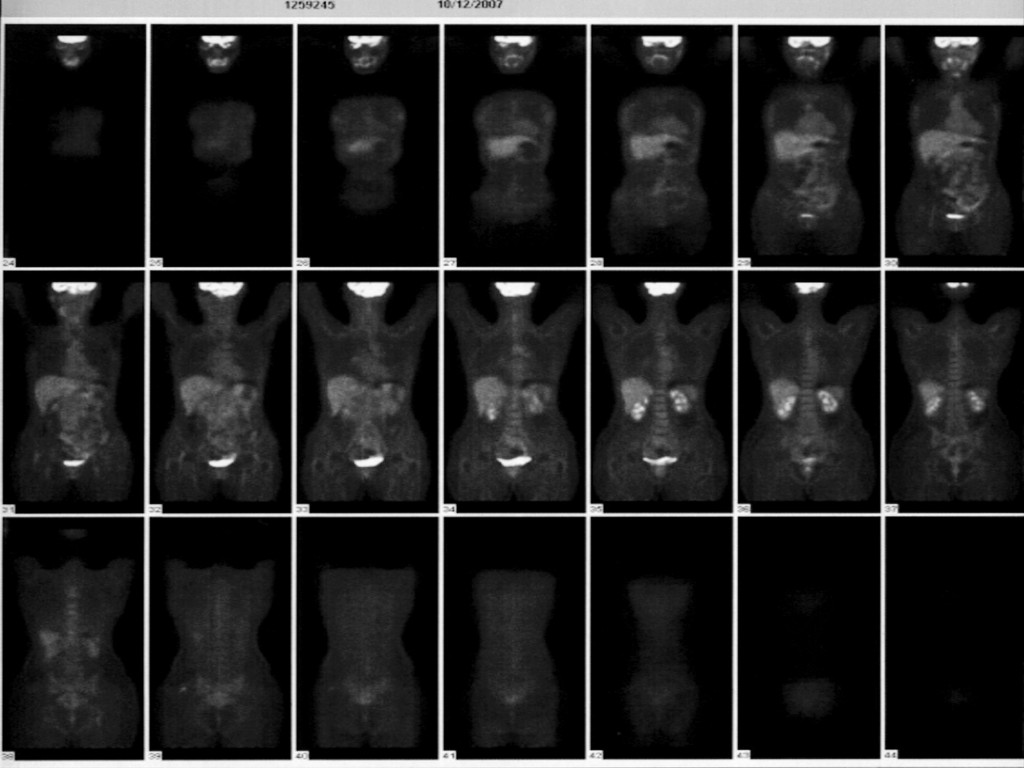
12/10/2007 –La PET ha confermato l’assenza di lesioni neoplastiche :- “La Tomoscintigrafia Globale corporea (PET ) con 18 F-FDG non ha dimostrato la presenza di aree di patologico accumulo del radiofarmaco da riferire a lesioni ad elevata attività metabolica ”
22/10/2007 – Anche l’ecografia e RX mammografico, negative, confermano la remissione : “” seni ricchi di tessuto ghiandolare con dotti galattofori in evidenza ed alcuni galattoceli periareolari senza immagini nodulari, micro-calçificazioni sospette o segni infiltrativi.
Un controllo ecografico ha rilevato nel seno ds la presenza di alcune cisti del massimo diametro di 5.6 mm. Non formazioni nodulari solide “”
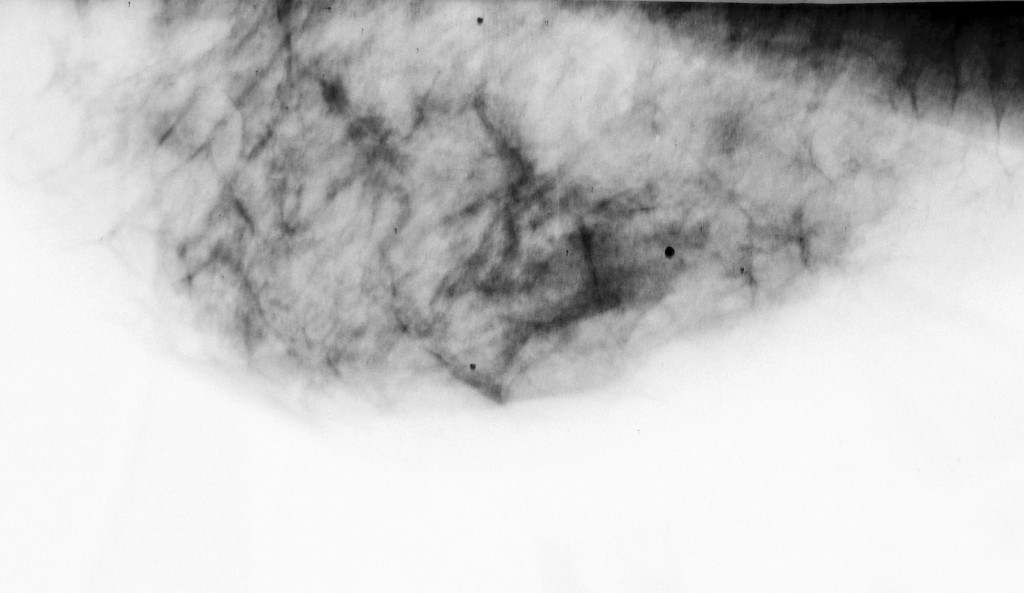
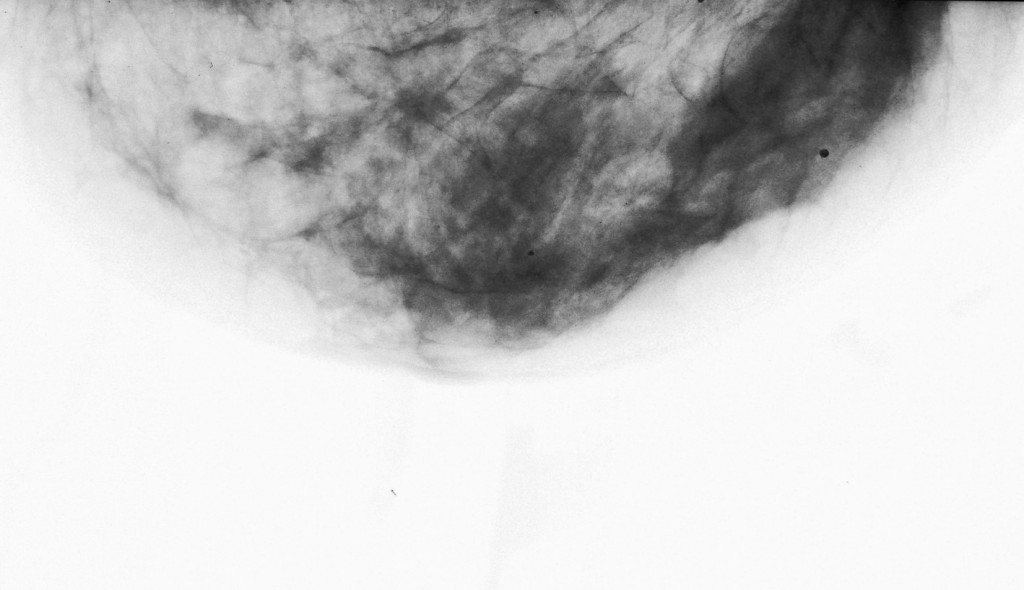
03/03/2008 –L’esame ecografico delle mammelle evidenzia la scomparsa di lesioni neoplastiche, e la stabilità del risultato ““.: seni ricchi di tessuto ghiandolare con dotti galattofori in evidenza ed anche galattoceli periareolari prevalenti a sinistra. Sono presenti cisti sparse in tutti i quadranti con massimo diametro di 8 mm ma non immagini nodulari solide o segni infitrativi. Si consiglia controllo dopo circa 6 mesi.””
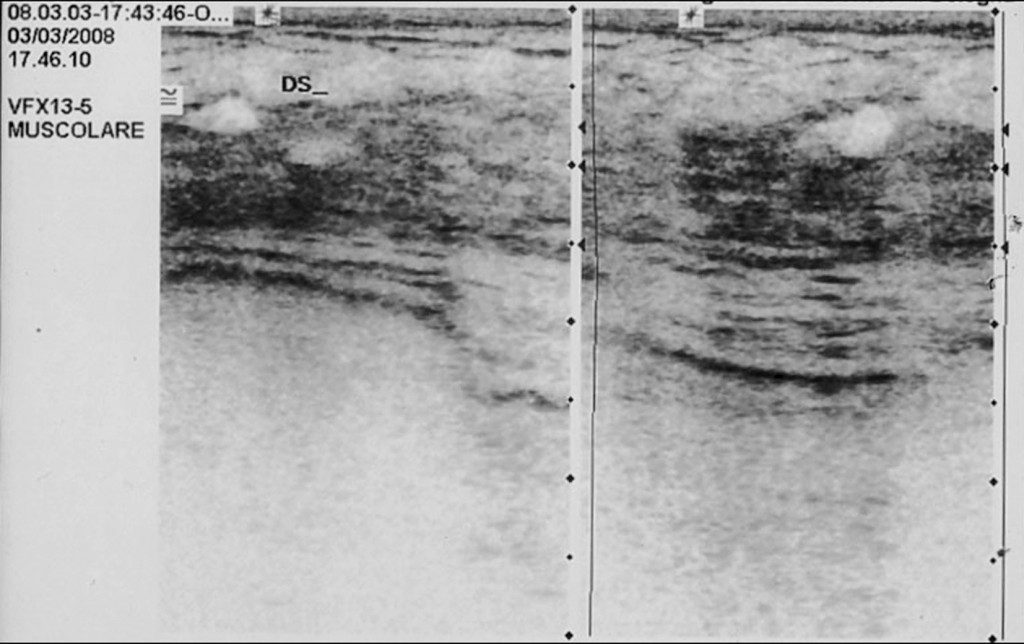
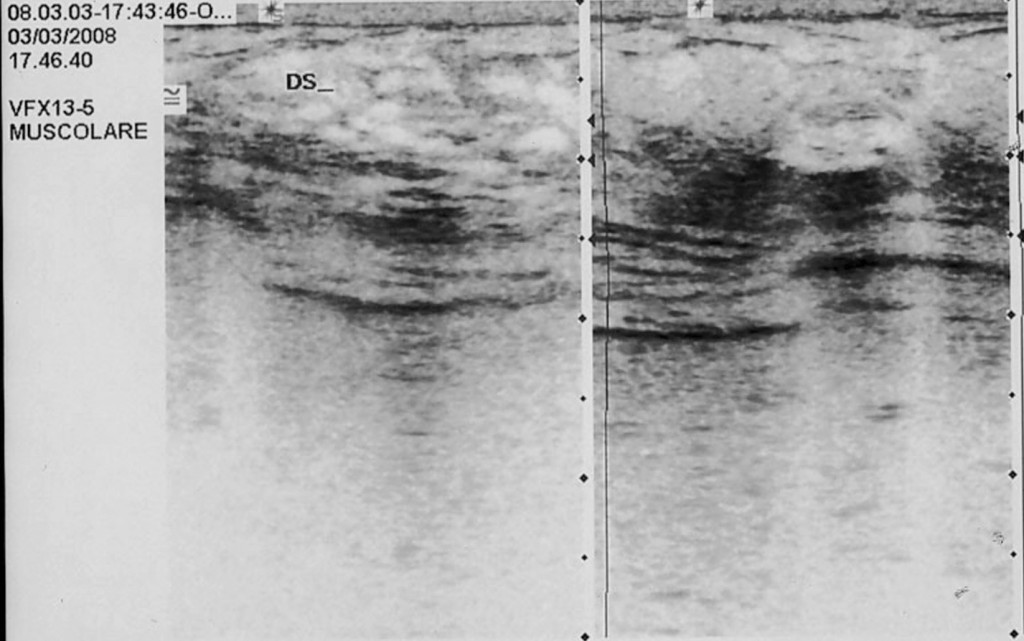
RISULTATI LA TERAPIA E IL DECORSO CLINICO.
La paziente, dopo aver rifiutato la mastectomia totale seguita da chemio e radioterapia propostale dal Centro Diagnostico Terapeutico per la Mammella - Istituto di Oncologia dell’Università di Ferrara (Italia), ha chiesto di essere curata con il Metodo Di Bella, che prevede l’impiego sinergico di molecole ad azione differenziante, citostatica, apoptotica, antiproliferativa, con incremento dell’attività immunitaria e in aggiunta, con finalità apoptotici, dosaggi minimi ( non citotossici, citolitici e pertanto non mutageni ) di Idrossiurea. Essa è stata impiegata in sostituzione dei 50 – 100 milligrammi di ciclofosfamide generalmente impiegati nel MDB per le lesioni cerebrali di sospetta natura ripetitiva neoplastica in considerazione della sua capacità di superare la barriera ematoencefalica.
La somministrazione continuativa per circa 10 mesi di 1000 milligrammi di idrossiurea, insieme a tutti i componenti del MDB, per l’azione mieloprotettiva, antidegenerativa e trofica su parenchimi e tessuti soprattutto della MLT e degli alti dosaggi di Vitamina E, Retinoidi, vitamine C e D3, non ha causato alcuna tossicità midollare, epatorenale, metabolica, cardiocircolatoria, neurologica, né depressione immunitaria.
Non ha provocato alcuna alterazione della crasi ematica e della dinamica midollare.
La paziente ha condotto a domicilio la terapia con una qualità di vita che ha consentito di svolgere pienamente un’intensa e impegnativa attività imprenditoriale.
Principi Attivi [ componenti della terapia prescritta (MDB)] :
1) Somatostatina (14 aminoacidi) iniettata sottocute di notte nell’arco di 10 ore mediante un temporizzatore per la breve emivita (circa 3 minuti) in coincidenza del picco notturno di increzione del GH
2) Octreotide, analogo della somatostatina (otto aminoacidi) in formulazione ritardo da 30 mg intramuscolo ogni 25 giorni, per una completa saturazione, sia recettoriale che temporale, con identiche finalità antiproliferative e proapoptotiche della somatostatina a 14 aminoacidi .
3) Bromocriptina da 2,5 mg 1\2 cpr mattino e sera per l’inibizione della prolattina, potente e ubiquitario ormone mitogeno.
4) Cabergolina 1\2 compressa 2 volte la settimana, potenziatore dell’attività della bromocriptina con emivita nettamente maggiore.
5) soluzione vitaminica, secondo la formulazione del prof. Di Bella:
Beta carotene…………………… gr 2
Axeroftolo palmitato … …………gr 1
Ac trans retinoico ( ATRA)…… gr 1
Alfatocoferile acetato ………… gr 1000
Un cucchiaio medio (100 mg x Kg di peso corporeo), almeno 15’ prima del pasto 3 volte al di’
6) Diidrotachisterolo (Vit D3 di sintesi): 10 gocce nello stesso cucchiaio assieme al composto vitaminico per ogni somministrazione ( 30 gocce al dì)
7) Melatonina chimicamente complessata con adenosina (mediante un legame di idrogeno) e glicina, secondo la formulazione del Prof Di Bella: Melatonina 12%, Adenosina 51%, Glicina 37%
8) Inibitore delle aromatasi una compressa al giorno
9) Idrossiurea -1000 mg per circa 10 mesi
10) Calcio 1 gr 2 volte al dì con l’acido ascorbico
11) Ac ascorbico2 gr, insieme al calcio in un bicchiere d’acqua x 2 volte al dì durante il pasto
12) Glucosamina solfato + Galattosamina solfato 500 mg x 3 volte al dì
La terapia biologica neuro-immuno-endocrina del Prof. Luigi Di Bella (MDB) ha lentamente e progressivamente ottenuto una risposta obiettiva completa, in assenza di tossicità, attraverso un meccanismo d’azione recettoriale, differenziante, apoptotico e antiproliferativo, con criteri, finalità e meccanismi d’azione totalmente difformi dalle consuete terapie citotossiche e citolitiche, dimostrando di potersi sostituire all’intervento chirurgico, e alla radioterapia e/o chemioterapia che comunque non si sostituiscono alla chirurgia, ma eventualmente la precedono e/o la seguono.
In questo caso, a causa della multifocalità neoplastica (con adenopatie ascellari bilaterali) era stata programmata e sollecitata da un istituto oncologico universitario una soluzione chirurgica radicale mediante mastectomia totale con svuotamento linfonodale ascellare seguita da chemio–radio, che la paziente ha rifiutato.
La risposta obiettiva al MDB (Metodo Di Bella) si è estesa alla risoluzione delle linfoadenopatie ascellari e lesioni endocraniche di dubbia natura secondaria, che non sono state più riscontrate.
DISCUSSIONE RAZIONALE DELLA TERAPIA
La perdita di differenziazione e la proliferazione, anche se in misura diversa, sono denominatori comuni a tutte le neoplasie. L’espressione recettoriale ubiquitaria della Prolattina [9,23] e del GH [32,14] rappresenta una delle conferme del ruolo mitogeno diretto e generalizzato di queste molecole.
La proliferazione cellulare è strettamente dipendente dalla Prolattina, dal GH, massimo fattore di crescita, e da molecole mitogene GH dipendenti, da esso positivamente regolate, come EGF, FGF, HGF, IGF1-2, NGF, PDGF, VEGF, TGF, oltre che da fattori di crescita prodotti dall’apparato gastrointestinale, come VIP, CCK, PG. Sia la proliferazione cellulare fisiologica che neoplastica, avvengono per mezzo di queste stesse molecole, che la cellula neoplastica utilizza in misura esponenziale rispetto a quella sana. Antidoti biologici del GH, come Somatostatina e analoghi, non riducono solo l’espressione e la trascrizione di fattori di crescita altamente mitogeni, come IGF1-2 [12,50,53], EGF [22], FGF [42], ma estendono la loro regolazione negativa ai rispettivi recettori con evidenti riflessi antiproliferativi, e antiangiogenici [56,43].
E’noto come l’asse GH-IGF1 abbia una determinate influenza sullo sviluppo biologico neoplastico. Gli IGFR rispondono mitogenicamente a IGF. L’effetto 13 soppressivo della SST e analoghi, sui livelli sierici di IGF1, è sia diretto, attraverso l’inibizione del gene di IGF, che indiretto, mediante la soppressione del GH e pertanto della sua induzione epatica di IGF1. Momenti essenziali dell’angiogenesi, passaggio essenziale della progressione neoplastica, come la cascata dei monociti, l’interleukina 8, oltre al concorso di fattori di crescita (il cui sinergismo è essenziale per l’angiogenesi stessa), come il VEGF, TGF, IGF1, FGF, HGF, PDGF, sono negativamente regolati da Somatostatina e analoghi [2,5,12,18,26,59,60,62,63].
L’inibizione dell’angiogenesi indotta dalla SST è sinergicamente potenziata da MLT [33,15,16], Retinoidi [40,28,36], vitamina D3 [29,39], Vitamina E [55,57,45], Vitamina C [3], inibitori prolattinici [59], componenti della matrice extracellulare [34,47] .
Ugualmente l’effetto citostatico, antiproliferativo, antimetastatico della Somatostatina è efficacemente sinergizzato dagli altri componenti del MDB: Retinoidi [20,61,48,46] MLT [7,31,41,35,13] Vit D3 [25,6,11] Cabergolina e Bromocriptina ( inibitori prolattinici) [19,9,33,30,38] Glucosamina solfato, Galattosamina solfato, componenti della matrice extracellulare [51,8] Vit E [58,24,37,45,55] Vit C [21,44,10]
È stato dimostrato [32] il rapporto causale tra espressione recettoriale del GH e induzione e progressione tumorale, rilevando istochimicamente concentrazioni di GHR nettamente superiori nei tessuti tumorali, rispetto ai fisiologici, evidenziando il potente ruolo mitogeno del GH con indice proliferativo dose dipendente. Esso è sia diretto, recettoriale, che indiretto, attraverso l’induzione dell’espressione epatica di IGF1, GH dipendente.
L’asse GH-IGF1 ha un ruolo determinante sul comportamento biologico di molte neoplasie. In un’elevatissima, subtotale percentuale di varietà di cellule neoplastiche sono stati individuati recettori IGF1 che rispondono mitogenicamente al ligando.
La Somatostatina esercita l’attività antiblastica sia direttamente, attraverso l’inibizione dell’espressione del gene IGF1, che indirettamente, mediante la soppressione del GH, da cui dipende l’increzione di IGF1 [50,53,54]. Ampiamente documentata è anche l’attività inibitoria della SST su un altro potente fattore di crescita mitogeno, EGF, attraverso molteplici meccanismi:
- inibizione dose dipendente della fosforilazione tirosinica indotta dall’attivazione di EGFR da parte di EGF [43];
- riduzione di EGFR nelle cellule tumorali [56];
- riduzione dell’espressione di EGF [22];
- abbattimento della concentrazione plasmatica di EGF [12].
Mitogeni prodotti dall’apparato gastrointestinale, come VIP, CCK, PG, sono potentemente inibiti dalla somatostatina e/o octreotide [27]. È stato dimostrato che i tumori al seno esprimono SSTR1, SSTR2, SSTR3, meno frequentemente SSTR5 [1,52], che almeno nel 50% dei casi sono scintigraficamente visibili, mentre in oltre la metà delle scintigrafie negative, indagini istochimiche hanno rilevato la presenza di STTR. Pertanto la presenza di STTR [1,4,49,17], e di recettori neuroendocrini in una rilevante percentuale di questi carcinomi, costituisce un’ulteriore indicazione razionale all’impiego della SST, peraltro già ampiamente giustificata dalla citata regolazione negativa della SST sul GH, gli oncogeni GH– correlati, e l’angiogenesi. Queste azioni della somatostatina e/o octreotide vedono potenziata la loro efficacia attraverso un meccanismo sinergico fattoriale con gli altri componenti del MDB.
La letteratura ha pertanto confermato i meccanismi d’azione antineoplastici differenzianti e antiproliferativi, antiangiogenetici e antimetastatici di tutti i componenti del MDB.
In questo caso gli esami ematochimici non hanno evidenziato danni, ma una progressiva riduzione della Prolattina, Estradiolo, IGF1 e il mantenimento di bassi livelli di GH.
Il risultato obiettivo, in assenza di tossicità, mediante la riduzione progressiva, fino alla scomparsa, delle 3 lesioni neoplastiche iniziali, delle adenopatie ascellari, delle sospette lesioni cerebrali, insieme al blocco di ogni disseminazione metastatica, evidenzia l’efficacia di questa terapia ed è conforme ai positivi risultati già pubblicati sull’uso del MDB nei LNH a basso grado e carcinomi polmonari al 3° e 4° stadio.
Il MDB, senza necessità di ricovero ospedaliero e neppure di day hospital, in assenza di tossicità e senza ridurre minimamente l’attività lavorativa, ha evitato il trauma chirurgico, e i rilevanti effetti collaterali di chemio e radioterapia.
L’applicazione precoce e come terapia di prima linea del MDB pertanto, in un organismo non debilitato dagli effetti tossici, mutageni e immunodepressivi della chemio-radioterapia, ha grandemente facilitato il risultato. Riteniamo utile segnalare il caso per invitare ad un maggiore interesse, studio e approfondimento sulle possibilità aperte in oncologia dalla terapia immunoneuroendocrina, biologica e recettoriale MDB.
REFERENZE
1. Albérini JL, Meunier B, Denzler B, Devillers A, Tass P, Dazord L, et al . Somatostatin receptor in breast cancer and axillary nodes: study with scintigraphy, histopathology and receptor autoradiography. Breast Cancer Res Treat. 2000; 61(1): 21-32.
2. Albini A, Florio T, Giunciuglio D, Masiello L, Carlone S, Corsaro A, et al. Somatostatin controls Kaposi's sarcoma tumor growth through inhibition of angiogenesis. FASEB J. 1999; 13(6): 647-655.
3. Ashino H, Shimamura M, Nakajima H, Dombou M, Kawanaka S, Oikawa T, et al. Novel function of ascorbic acid as an angiostatic factor. Angiogenesis. 2003; 6(4): 259-269.
4. Barnett P. Somatostatin and somatostatin receptor physiology. Endocrine. 2003; 20(3): 255-264.
5. Barrie R, Woltering EA, Hajarizadeh H, Mueller C, Ure T, Fletcher WS. Inhibition of angiogenesis by somatostatin and somatostatin-like compounds is structurally dependent. J Surg Res. 1993; 55(4): 446-450.
6. Barroga EF, Kadosawa T, Okumura M, Fujinaga T. Inhibitory effects of 22-oxa-calcitriol and all- trans retinoic acid on the growth of a canine osteosarcoma derived cell-line in vivo and its pulmonary metastasis in vivo. Res Vet Sci. 2000; 68(1): 79-87.
7. Bartsch C, Bartsch H, Buchberger A, Stieglitz A, Effenberger-Klein A, Kruse-Jarres JD, et al. Serial transplants of DMBA-induced mammary tumors in Fischer rats as a model system for human breast cancer. VI. The role of different forms of tumor-associated stress for the regulation of pineal melatonin secretion. Oncology. 1999; 56(2): 169-176.
8. Batra RK, Olsen JC, Hoganson DK, Caterson B, Boucher RC. Retroviral gene transfer is inhibited by chondroitin sulfate roteoglycans/glycosaminoglycans in malignant pleural effusions. J Biol Chem. 1997; 272(18): 11736-43.
9. Ben-Jonathan N, Liby K, McFarland M, Zinger M. Prolactin as an autocrine/paracrine growth factor in human cancer. Trends Endocrinol Metab. 2002; 13(6):245-250.
10. Cameron E, Pauling L, Leibovitz B. Ascorbic acid and cancer: a review. Cancer Res. 1979; 39(3): 663-681.
11. Campbell MJ, Gombart AF, Kwok SH, Park S, Koeffler HP. The anti-proliferative effects of 1alpha,25(OH)2D3 on breast and prostate cancer cells are associated with induction of BRCA1 gene expression. Oncogene. 2000; 19(44): 5091-7.
12. Cascinu S, Del Ferro E, Ligi M, Staccioli MP, Giordani P, Catalano V, et al. Inhibition of vascular endothelial growth factor by octreotide in colorectal cancer patients. Cancer Invest. 2001; 19(1): 8-12.
13. Cos S, Sánchez-Barceló EJ. Melatonin and mammary pathological growth. Front Neuroendocrinol. 2000; 21(2): 133-170.
14. De Souza I, Morgan L, Lewis UL, Raggatt PR, Salih H, Hobbs JR. Growth-hormone dependence among human breast cancers. Lancet. 1974; 2(7874):182-184.
15. Di Bella L, Rossi MT, Scalera G. Perspectives in pineal functions. Prog Brain Res. 1979; 52: 475-478.
16. Di Bella L, Gualano L. Key aspects of melatonin physiology: thirty years of research. NeuroEndocrinol Lett. 2006; 27(4): 425-432.
17. van Eijck CH, Kwekkeboom DJ, Krenning EP. Somatostatin receptors and breast cancer. Q J Nucl Med. 1998; 42(1): 18-25.
18. Florio T, Morini M, Villa V, Arena S, Corsaro A, Thellung S, et al. Somatostatin inhibits tumor angiogenesis and growth via somatostatin receptor-3-mediated regulation of endothelial nitric oxide synthase and mitogen-activated protein kinase activities. Endocrinology. 2003; 144(4): 1574-1584.
19. Gruszka A, Pawlikowski M, Kunert-Radek J. Anti-tumoral action of octreotide and bromocriptine on the experimental rat prolactinoma: anti-proliferative and pro-apoptotic effects. Neuro Endocrinol Lett. 2001; 22(5): 343-348.
20. Hassan HT, Rees J. Triple combination of retinoic acid plus actinomycin D plus dimethylformamide induces differentiation of human acute myeloid leukaemic blasts in primary culture. Cancer Chemother Pharmacol. 1990; 26(1): 26-30.
21. Head KA. Ascorbic acid in the prevention and treatment of cancer. Altern Med Rev. 1998; 3(3): 174-186.
22. Held-Feindt J, Krisch B, Mentlein R. Molecular analysis of the somatostatin receptor subtype 2 in human glioma cells. Brain Res Mol Brain Res. 1999; 64(1): 101-7.
23. Hooghe R, Merchav S, Gaidano G, Naessens F, Matera L. A role for growth hormone and prolactin in leukaemia and lymphoma? Cell Mol Life Sci. 1998; 54(10): 1095-1101.
24. Israel K, Yu W, Sanders BG, Kline K. Vitamin E succinate induces apoptosis in human prostate cancer cells: role for Fas in vitamin E succinate-triggered apoptosis. Nutr Cancer. 2000; 36(1): 90-100.
25. Jensen SS, Madsen MW, Lukas J, Binderup L, Bartek J. Inhibitory effects of 1alpha,25-dihydroxyvitamin D(3) on the G(1)-S phase-controlling machinery. Mol Endocrinol. 2001; 15(8): 1370-1380.
26. Jia WD, Xu GL, Xu RN, Sun HC, Wang L, Yu JH, et al. Octreotide acts as an antitumor angiogenesis compound and suppresses tumor growth in nude mice bearing human hepatocellular carcinoma xenografts. J Cancer Res Clin Oncol. 2003; 129(6): 327-334.
27. Kath R, Höffken K. The significance of somatostatin analogues in the antiproliferative treatment of carcinomas. Recent Results Cancer Res. 2000; 153: 23-43.
28. Kini AR, Peterson LA, Tallman MS, Lingen MW. Angiogenesis in acute promyelocytic leukemia: induction by vascular endothelial growth factor and inhibition by all-trans retinoic acid. Blood. 2001; 97(12): 3919-3924
29. Kisker O, Onizuka S, Becker CM, Fannon M, Flynn E, D'Amato R, et al. Vitamin D binding protein-macrophage activating factor (DBP-maf) inhibits angiogenesis and tumor growth in mice. Neoplasia. 2003; 5(1): 32-40.
30. Klijn JG, Setyono-Han B, Bontenbal M, Seynaeve C, Foekens J. Novel endocrine therapies in breast cancer. Acta Oncol. 1996; 35 Suppl 5: 30-37.
31. Kvetnoĭ IM, Levin IM. Melatonin and tumor growth.(In Russian with English abstract). Eksp Onkol. 1986; 8(4): 11-15.
32. Lincoln DT, Sinowatz F, Temmim-Baker L, Baker HI, Kölle S, Waters MJ. Growth hormone receptor expression in the nucleus and cytoplasm of normal and neoplastic cells. Histochem Cell Biol. 1998; 109(2): 141-159.
33. Lissoni P, Rovelli F, Malugani F, Bucovec R, Conti A, Maestroni GJ. Anti-angiogenic activity of melatonin in advanced cancer patients. Neuro Endocrinol Lett. 2001; 22(1): 45-47.
34. Liu Y, Yang H, Otaka K, Takatsuki H, Sakanishi A. Effects of vascular endothelial growth factor (VEGF) and chondroitin sulfate A on human monocytic THP-1 cell migration. Colloids Surf B Biointerfaces. 2005; 43(3-4): 216-220.
35. Maestroni GJ, Hertens E, Galli P, Conti A, Pedrinis E. Melatonin-induced T-helper cell hematopoietic cytokines resembling both interleukin-4 and dynorphin. J Pineal Res. 1996; 21(3): 131-9.
36. Majewski S, Szmurlo A, Marczak M, Jablonska S, Bollag W. Synergistic effect of retinoids and interferon alpha on tumor-induced angiogenesis: anti-angiogenic effect on HPV-harboring tumor-cell lines. Int J Cancer. 1994; 57(1): 81-85.
37. Malafa MP, Fokum FD, Smith L, Louis A. Inhibition of angiogenesis and promotion of melanoma dormancy by vitamin E succinate. Ann Surg Oncol. 2002; 9(10): 1023-1032.
38. Manni A, Boucher AE, Demers LM, Harvey HA, Lipton A, Simmonds MA, et al. Endocrine effects of combined somatostatin analog and bromocriptine therapy in women with advanced breast cancer. Breast Cancer Res Treat. 1989; 14(3): 289-298.
39. Mantell DJ, Owens PE, Bundred NJ, Mawer EB, Canfield AE. 1 alpha,25-dihydroxyvitamin D(3) inhibits angiogenesis in vitro and in vivo. Circ Res. 2000; 87(3): 214-220.
40. McMillan K, Perepelitsyn I, Wang Z, Shapshay SM. Tumor growth inhibition and regression induced by photothermal vascular targeting and angiogenesis inhibitor retinoic acid. Cancer Lett. 1999; 137(1): 35-44.
41. Mediavilla MD, Cos S, Sánchez-Barceló EJ. Melatonin increases p53 and p21WAF1 expression in MCF-7 human breast cancer cells in vitro. Life Sci. 1999; 65(4): 415-420.
42. Mentlein R, Eichler O, Forstreuter F, Held-Feindt J. Somatostatin inhibits the production of vascular endothelial growth factor in human glioma cells. Int J Cancer. 2001; 92(4): 545-550.
43. Mishima M, Yano T, Jimbo H, Yano N, Morita Y, Yoshikawa H, et al. Inhibition of human endometrial cancer cell growth in vitro and in vivo by somatostatin analog RC-160. Am J Obstet Gynecol. 1999; 181(3): 583-590.
44. Murata A, Morishige F, Yamaguchi H. Prolongation of survival times of terminal cancer patients by administration of large doses of ascorbate. Int J Vitam Nutr Res Suppl. 1982; 23: 103-113.
45. Neuzil J, Kagedal K, Andera L, Weber C, Brunk UT. Vitamin E analogs: a new class of multiple action agents with anti-neoplastic and anti-atherogenic activity. Apoptosis. 2002; 7(2): 179-87.
46. Onogi N, Okuno M, Matsushima-Nishiwaki R, Fukutomi Y, Moriwaki H, Muto Y, et al. Antiproliferative effect of carotenoids on human colon cancer cells without conversion to retinoic acid. Nutr Cancer. 1998; 32(1): 20-24.
47. Ozerdem U, Stallcup WB. Pathological angiogenesis is reduced by targeting pericytes via the NG2 proteoglycan. Angiogenesis. 2004; 7(3): 269-276.
48. Piedrafita FJ, Pfahl M. Retinoid-induced apoptosis and Sp1 cleavage occur independently of transcription and require caspase activation. Mol Cell Biol. 1997; 17(11): 6348-58.
49. Pinzani P, Orlando C, Raggi CC, Distante V, Valanzano R, Tricarico C, et al. Type-2 somatostatin receptor mRNA levels in breast and colon cancer determined by a quantitative RT-PCR assay based on dual label fluorogenic probe and the TaqMan technology. Regul Pept. 2001; 99(2-3): 79-86.
50. Pollak M. The potential role of somatostatin analogues in breast cancer treatment. Yale J Biol Med. 1997; 70(5-6): 535-539.
51. Pumphrey CY, Theus AM, Li S, Parrish RS, Sanderson RD. Neoglycans, carbodiimide-modified glycosaminoglycans: a new class of anticancer agents that inhibit cancer cell proliferation and induce apoptosis. Cancer Res. 2002; 62(13): 3722-8.
52. Schaer JC, Waser B, Mengod G, Reubi JC. Somatostatin receptor subtypes sst1, sst2, sst3 and sst5 expression in human pituitary, gastroentero-pancreatic and mammary tumors: comparison of mRNA analysis with receptor autoradiography. Int J Cancer. 1997; 70(5): 530-537.
53. Schally AV, Comaru-Schally AM, Nagy A, Kovacs M, Szepeshazi K, Plonowski A, et al. Hypothalamic hormones and cancer. Front Neuroendocrinol. 2001; 22(4): 248-291.
54. Schally AV, Nagy A. New approaches to treatment of various cancers based on cytotoxic analogs of LHRH, somatostatin and bombesin. Life Sci. 2003; 72(21): 2305-20.
55. Shklar G, Schwartz JL. Vitamin E inhibits experimental carcinogenesis and tumour angiogenesis. Eur J Cancer B Oral Oncol. 1996; 32B(2): 114-119.
56. Szepesházi K, Halmos G, Schally AV, Arencibia JM, Groot K, Vadillo-Buenfil M, et al. Growth inhibition of experimental pancreatic cancers and sustained reduction in epidermal growth factor receptors during therapy with hormonal peptide analogs. J Cancer Res Clin Oncol. 1999; 125(8-9): 444-452.
57. Tang FY, Meydani M. Green tea catechins and vitamin E inhibit angiogenesis of human microvascular endothelial cells through suppression of IL-8 production. Nutr Cancer. 2001; 41(1-2): 119-125.
58. Turley JM, Funakoshi S, Ruscetti FW, Kasper J, Murphy WJ, Longo DL, et al. Growth inhibition and apoptosis of RL human B lymphoma cells by vitamin E succinate and retinoic acid: role for transforming growth factor beta. Cell Growth Differ. 1995; 6(6): 655-663.
59. Turner HE, Nagy Z, Gatter KC, Esiri MM, Harris AL, Wass JA. Angiogenesis in pituitary adenomas - relationship to endocrine function, treatment and outcome. J Endocrinol. 2000; 165(2): 475-481.
60. Vidal S, Oliveira MC, Kovacs K, Scheithauer BW, Lloyd R. Immunolocalization of vascular endothelial growth factor in the GH3 cell line. Cell Tissue Res. 2000; 300(1): 83-88.
61. Voigt A, Hartmann P, Zintl F. Differentiation, proliferation and adhesion of human neuroblastoma cells after treatment with retinoic acid. Cell Adhes Commun. 2000; 7(5): 423-440.
62. Watson JC, Balster DA, Gebhardt BM, O'Dorisio TM, O'Dorisio MS, Espenan GD, et al. Growing vascular endothelial cells express somatostatin subtype 2 receptors. Br J Cancer. 2001; 85(2): 266-272.
63. Wiedermann CJ, Reinisch N, Braunsteiner H. Stimulation of monocyte chemotaxis by human growth hormone and its deactivation by somatostatin. Blood. 1993; 82(3): 954-960.
2. Albini A, Florio T, Giunciuglio D, Masiello L, Carlone S, Corsaro A, et al. Somatostatin controls Kaposi's sarcoma tumor growth through inhibition of angiogenesis. FASEB J. 1999; 13(6): 647-655.
3. Ashino H, Shimamura M, Nakajima H, Dombou M, Kawanaka S, Oikawa T, et al. Novel function of ascorbic acid as an angiostatic factor. Angiogenesis. 2003; 6(4): 259-269.
4. Barnett P. Somatostatin and somatostatin receptor physiology. Endocrine. 2003; 20(3): 255-264.
5. Barrie R, Woltering EA, Hajarizadeh H, Mueller C, Ure T, Fletcher WS. Inhibition of angiogenesis by somatostatin and somatostatin-like compounds is structurally dependent. J Surg Res. 1993; 55(4): 446-450.
6. Barroga EF, Kadosawa T, Okumura M, Fujinaga T. Inhibitory effects of 22-oxa-calcitriol and all- trans retinoic acid on the growth of a canine osteosarcoma derived cell-line in vivo and its pulmonary metastasis in vivo. Res Vet Sci. 2000; 68(1): 79-87.
7. Bartsch C, Bartsch H, Buchberger A, Stieglitz A, Effenberger-Klein A, Kruse-Jarres JD, et al. Serial transplants of DMBA-induced mammary tumors in Fischer rats as a model system for human breast cancer. VI. The role of different forms of tumor-associated stress for the regulation of pineal melatonin secretion. Oncology. 1999; 56(2): 169-176.
8. Batra RK, Olsen JC, Hoganson DK, Caterson B, Boucher RC. Retroviral gene transfer is inhibited by chondroitin sulfate roteoglycans/glycosaminoglycans in malignant pleural effusions. J Biol Chem. 1997; 272(18): 11736-43.
9. Ben-Jonathan N, Liby K, McFarland M, Zinger M. Prolactin as an autocrine/paracrine growth factor in human cancer. Trends Endocrinol Metab. 2002; 13(6):245-250.
10. Cameron E, Pauling L, Leibovitz B. Ascorbic acid and cancer: a review. Cancer Res. 1979; 39(3): 663-681.
11. Campbell MJ, Gombart AF, Kwok SH, Park S, Koeffler HP. The anti-proliferative effects of 1alpha,25(OH)2D3 on breast and prostate cancer cells are associated with induction of BRCA1 gene expression. Oncogene. 2000; 19(44): 5091-7.
12. Cascinu S, Del Ferro E, Ligi M, Staccioli MP, Giordani P, Catalano V, et al. Inhibition of vascular endothelial growth factor by octreotide in colorectal cancer patients. Cancer Invest. 2001; 19(1): 8-12.
13. Cos S, Sánchez-Barceló EJ. Melatonin and mammary pathological growth. Front Neuroendocrinol. 2000; 21(2): 133-170.
14. De Souza I, Morgan L, Lewis UL, Raggatt PR, Salih H, Hobbs JR. Growth-hormone dependence among human breast cancers. Lancet. 1974; 2(7874):182-184.
15. Di Bella L, Rossi MT, Scalera G. Perspectives in pineal functions. Prog Brain Res. 1979; 52: 475-478.
16. Di Bella L, Gualano L. Key aspects of melatonin physiology: thirty years of research. NeuroEndocrinol Lett. 2006; 27(4): 425-432.
17. van Eijck CH, Kwekkeboom DJ, Krenning EP. Somatostatin receptors and breast cancer. Q J Nucl Med. 1998; 42(1): 18-25.
18. Florio T, Morini M, Villa V, Arena S, Corsaro A, Thellung S, et al. Somatostatin inhibits tumor angiogenesis and growth via somatostatin receptor-3-mediated regulation of endothelial nitric oxide synthase and mitogen-activated protein kinase activities. Endocrinology. 2003; 144(4): 1574-1584.
19. Gruszka A, Pawlikowski M, Kunert-Radek J. Anti-tumoral action of octreotide and bromocriptine on the experimental rat prolactinoma: anti-proliferative and pro-apoptotic effects. Neuro Endocrinol Lett. 2001; 22(5): 343-348.
20. Hassan HT, Rees J. Triple combination of retinoic acid plus actinomycin D plus dimethylformamide induces differentiation of human acute myeloid leukaemic blasts in primary culture. Cancer Chemother Pharmacol. 1990; 26(1): 26-30.
21. Head KA. Ascorbic acid in the prevention and treatment of cancer. Altern Med Rev. 1998; 3(3): 174-186.
22. Held-Feindt J, Krisch B, Mentlein R. Molecular analysis of the somatostatin receptor subtype 2 in human glioma cells. Brain Res Mol Brain Res. 1999; 64(1): 101-7.
23. Hooghe R, Merchav S, Gaidano G, Naessens F, Matera L. A role for growth hormone and prolactin in leukaemia and lymphoma? Cell Mol Life Sci. 1998; 54(10): 1095-1101.
24. Israel K, Yu W, Sanders BG, Kline K. Vitamin E succinate induces apoptosis in human prostate cancer cells: role for Fas in vitamin E succinate-triggered apoptosis. Nutr Cancer. 2000; 36(1): 90-100.
25. Jensen SS, Madsen MW, Lukas J, Binderup L, Bartek J. Inhibitory effects of 1alpha,25-dihydroxyvitamin D(3) on the G(1)-S phase-controlling machinery. Mol Endocrinol. 2001; 15(8): 1370-1380.
26. Jia WD, Xu GL, Xu RN, Sun HC, Wang L, Yu JH, et al. Octreotide acts as an antitumor angiogenesis compound and suppresses tumor growth in nude mice bearing human hepatocellular carcinoma xenografts. J Cancer Res Clin Oncol. 2003; 129(6): 327-334.
27. Kath R, Höffken K. The significance of somatostatin analogues in the antiproliferative treatment of carcinomas. Recent Results Cancer Res. 2000; 153: 23-43.
28. Kini AR, Peterson LA, Tallman MS, Lingen MW. Angiogenesis in acute promyelocytic leukemia: induction by vascular endothelial growth factor and inhibition by all-trans retinoic acid. Blood. 2001; 97(12): 3919-3924
29. Kisker O, Onizuka S, Becker CM, Fannon M, Flynn E, D'Amato R, et al. Vitamin D binding protein-macrophage activating factor (DBP-maf) inhibits angiogenesis and tumor growth in mice. Neoplasia. 2003; 5(1): 32-40.
30. Klijn JG, Setyono-Han B, Bontenbal M, Seynaeve C, Foekens J. Novel endocrine therapies in breast cancer. Acta Oncol. 1996; 35 Suppl 5: 30-37.
31. Kvetnoĭ IM, Levin IM. Melatonin and tumor growth.(In Russian with English abstract). Eksp Onkol. 1986; 8(4): 11-15.
32. Lincoln DT, Sinowatz F, Temmim-Baker L, Baker HI, Kölle S, Waters MJ. Growth hormone receptor expression in the nucleus and cytoplasm of normal and neoplastic cells. Histochem Cell Biol. 1998; 109(2): 141-159.
33. Lissoni P, Rovelli F, Malugani F, Bucovec R, Conti A, Maestroni GJ. Anti-angiogenic activity of melatonin in advanced cancer patients. Neuro Endocrinol Lett. 2001; 22(1): 45-47.
34. Liu Y, Yang H, Otaka K, Takatsuki H, Sakanishi A. Effects of vascular endothelial growth factor (VEGF) and chondroitin sulfate A on human monocytic THP-1 cell migration. Colloids Surf B Biointerfaces. 2005; 43(3-4): 216-220.
35. Maestroni GJ, Hertens E, Galli P, Conti A, Pedrinis E. Melatonin-induced T-helper cell hematopoietic cytokines resembling both interleukin-4 and dynorphin. J Pineal Res. 1996; 21(3): 131-9.
36. Majewski S, Szmurlo A, Marczak M, Jablonska S, Bollag W. Synergistic effect of retinoids and interferon alpha on tumor-induced angiogenesis: anti-angiogenic effect on HPV-harboring tumor-cell lines. Int J Cancer. 1994; 57(1): 81-85.
37. Malafa MP, Fokum FD, Smith L, Louis A. Inhibition of angiogenesis and promotion of melanoma dormancy by vitamin E succinate. Ann Surg Oncol. 2002; 9(10): 1023-1032.
38. Manni A, Boucher AE, Demers LM, Harvey HA, Lipton A, Simmonds MA, et al. Endocrine effects of combined somatostatin analog and bromocriptine therapy in women with advanced breast cancer. Breast Cancer Res Treat. 1989; 14(3): 289-298.
39. Mantell DJ, Owens PE, Bundred NJ, Mawer EB, Canfield AE. 1 alpha,25-dihydroxyvitamin D(3) inhibits angiogenesis in vitro and in vivo. Circ Res. 2000; 87(3): 214-220.
40. McMillan K, Perepelitsyn I, Wang Z, Shapshay SM. Tumor growth inhibition and regression induced by photothermal vascular targeting and angiogenesis inhibitor retinoic acid. Cancer Lett. 1999; 137(1): 35-44.
41. Mediavilla MD, Cos S, Sánchez-Barceló EJ. Melatonin increases p53 and p21WAF1 expression in MCF-7 human breast cancer cells in vitro. Life Sci. 1999; 65(4): 415-420.
42. Mentlein R, Eichler O, Forstreuter F, Held-Feindt J. Somatostatin inhibits the production of vascular endothelial growth factor in human glioma cells. Int J Cancer. 2001; 92(4): 545-550.
43. Mishima M, Yano T, Jimbo H, Yano N, Morita Y, Yoshikawa H, et al. Inhibition of human endometrial cancer cell growth in vitro and in vivo by somatostatin analog RC-160. Am J Obstet Gynecol. 1999; 181(3): 583-590.
44. Murata A, Morishige F, Yamaguchi H. Prolongation of survival times of terminal cancer patients by administration of large doses of ascorbate. Int J Vitam Nutr Res Suppl. 1982; 23: 103-113.
45. Neuzil J, Kagedal K, Andera L, Weber C, Brunk UT. Vitamin E analogs: a new class of multiple action agents with anti-neoplastic and anti-atherogenic activity. Apoptosis. 2002; 7(2): 179-87.
46. Onogi N, Okuno M, Matsushima-Nishiwaki R, Fukutomi Y, Moriwaki H, Muto Y, et al. Antiproliferative effect of carotenoids on human colon cancer cells without conversion to retinoic acid. Nutr Cancer. 1998; 32(1): 20-24.
47. Ozerdem U, Stallcup WB. Pathological angiogenesis is reduced by targeting pericytes via the NG2 proteoglycan. Angiogenesis. 2004; 7(3): 269-276.
48. Piedrafita FJ, Pfahl M. Retinoid-induced apoptosis and Sp1 cleavage occur independently of transcription and require caspase activation. Mol Cell Biol. 1997; 17(11): 6348-58.
49. Pinzani P, Orlando C, Raggi CC, Distante V, Valanzano R, Tricarico C, et al. Type-2 somatostatin receptor mRNA levels in breast and colon cancer determined by a quantitative RT-PCR assay based on dual label fluorogenic probe and the TaqMan technology. Regul Pept. 2001; 99(2-3): 79-86.
50. Pollak M. The potential role of somatostatin analogues in breast cancer treatment. Yale J Biol Med. 1997; 70(5-6): 535-539.
51. Pumphrey CY, Theus AM, Li S, Parrish RS, Sanderson RD. Neoglycans, carbodiimide-modified glycosaminoglycans: a new class of anticancer agents that inhibit cancer cell proliferation and induce apoptosis. Cancer Res. 2002; 62(13): 3722-8.
52. Schaer JC, Waser B, Mengod G, Reubi JC. Somatostatin receptor subtypes sst1, sst2, sst3 and sst5 expression in human pituitary, gastroentero-pancreatic and mammary tumors: comparison of mRNA analysis with receptor autoradiography. Int J Cancer. 1997; 70(5): 530-537.
53. Schally AV, Comaru-Schally AM, Nagy A, Kovacs M, Szepeshazi K, Plonowski A, et al. Hypothalamic hormones and cancer. Front Neuroendocrinol. 2001; 22(4): 248-291.
54. Schally AV, Nagy A. New approaches to treatment of various cancers based on cytotoxic analogs of LHRH, somatostatin and bombesin. Life Sci. 2003; 72(21): 2305-20.
55. Shklar G, Schwartz JL. Vitamin E inhibits experimental carcinogenesis and tumour angiogenesis. Eur J Cancer B Oral Oncol. 1996; 32B(2): 114-119.
56. Szepesházi K, Halmos G, Schally AV, Arencibia JM, Groot K, Vadillo-Buenfil M, et al. Growth inhibition of experimental pancreatic cancers and sustained reduction in epidermal growth factor receptors during therapy with hormonal peptide analogs. J Cancer Res Clin Oncol. 1999; 125(8-9): 444-452.
57. Tang FY, Meydani M. Green tea catechins and vitamin E inhibit angiogenesis of human microvascular endothelial cells through suppression of IL-8 production. Nutr Cancer. 2001; 41(1-2): 119-125.
58. Turley JM, Funakoshi S, Ruscetti FW, Kasper J, Murphy WJ, Longo DL, et al. Growth inhibition and apoptosis of RL human B lymphoma cells by vitamin E succinate and retinoic acid: role for transforming growth factor beta. Cell Growth Differ. 1995; 6(6): 655-663.
59. Turner HE, Nagy Z, Gatter KC, Esiri MM, Harris AL, Wass JA. Angiogenesis in pituitary adenomas - relationship to endocrine function, treatment and outcome. J Endocrinol. 2000; 165(2): 475-481.
60. Vidal S, Oliveira MC, Kovacs K, Scheithauer BW, Lloyd R. Immunolocalization of vascular endothelial growth factor in the GH3 cell line. Cell Tissue Res. 2000; 300(1): 83-88.
61. Voigt A, Hartmann P, Zintl F. Differentiation, proliferation and adhesion of human neuroblastoma cells after treatment with retinoic acid. Cell Adhes Commun. 2000; 7(5): 423-440.
62. Watson JC, Balster DA, Gebhardt BM, O'Dorisio TM, O'Dorisio MS, Espenan GD, et al. Growing vascular endothelial cells express somatostatin subtype 2 receptors. Br J Cancer. 2001; 85(2): 266-272.
63. Wiedermann CJ, Reinisch N, Braunsteiner H. Stimulation of monocyte chemotaxis by human growth hormone and its deactivation by somatostatin. Blood. 1993; 82(3): 954-960.

