28 casi di cancro del polmone non a piccole cellule in fase avanzata, con basso Performance Status.
Pubblicato il 13/01/2015
SCOPO: I pazienti con cancro del polmone non a piccole cellule (NSCLC) in fase avanzata, con basso Performance Status (PS) hanno una scarsa prognosi. In questi pazienti abbiamo determinato la sopravvivenza, i benefici clinici e la tossicità di un regime multiterapico basato su ciclofosfamide ed agenti bioterapeutici.
METODI: Pazienti con una diagnosi di NSCLC stadio IIIB o IV, con nessuna precedente chirurgia o chemio-radioterapia ed un Performance Status (PS) ≥ 2 (scala ECOG) hanno ricevuto una combinazione giornaliera di somatostatina, retinoidi, melatonina, vitamina D, bromocriptina e ciclofosfamide.
RISULTATI: Sono stati arruolati 28 pazienti. L'età mediana era 64 anni (intervallo: 35-74). Il PS era 2 e 3 nel 78.6% e nel 21.4% di pazienti, rispettivamente. La sopravvivenza generale mediana (analisi intenzione al trattamento) era 12.9 mesi (intervallo 1.5-33.5 mesi). I tassi di sopravvivenza generale ad 1- e 2 anni erano il 51,2% e il 21,1%, rispettivamente. Gli effetti collaterali erano molto lievi, costituiti prevalentemente da diarrea, nausea/vomito e sonnolenza di grado 1-2. La maggior parte dei pazienti ha mostrato un miglioramento dei sintomi sia respiratori (tosse e dispnea) che generali (dolore, fatica ed insonnia). CONCLUSIONI: Pazienti con NSCLC avanzato e basso PS possono trarre beneficio da una combinazione di somatostatina, retinoidi, melatonina, vitamina D, bromocriptina e ciclofosfamide, in termini di sopravvivenza e di qualità della vita, con effetti collaterali molto bassi.
INTRODUZIONE
Nei paesi occidentali, il tumore del polmone causa il maggior numero di morti dovuti al cancro (1).
Il cancro del polmone non a piccole cellule (NSCLC – Non Small Cell Lung Cancer), inclusi i sottotipi istologici squamoso, adenocarcinoma e carcinoma a grandi cellule, comprende circa l'80% di tutti i tumori del polmone. Secondo il Sistema Internazionale di Stadiazione per il cancro del polmone (International Staging System for Lung Cancer), in generale, il NSCLC avanzato corrisponde ai pazienti con stadio IIIB e IV della malattia (2).
Quando trattati con sola terapia di supporto (Best Supportive Care), i pazienti con NSCLC avanzato hanno una sopravvivenza mediana di 3-4 mesi, con una sopravvivenza ad 1 anno di circa il 15% (3-5). Meta-analisi hanno mostrato che l'aggiunta di chemioterapia a base di platino produce un miglioramento modesto, ma statisticamente significativo, nella sopravvivenza mediana con un miglioramento del 10-15% nella sopravvivenza ad 1 anno, rispetto al solo trattamento con terapia di supporto. Quindi, la chemioterapia a base di platino è il trattamento consigliato standard per il NSCLC avanzato (3-5).
Per pazienti con NSCLC avanzato, uno dei più importanti fattori prognostici è il “Performance Status (PS)”, cioè lo stato di validità clinica generale del paziente (6,7). Il vantaggio clinico ottenibile con la chemioterapia a base di platino sembra che essere limitato ai pazienti con un buon PS (valori 0-1 della scala ECOG). Al contrario, pazienti con un PS ≥ 2 sembrano non avere nessun vantaggio, in termini di sopravvivenza, da trattamenti a base di platino (8,9). Inoltre, diverse sperimentazioni cliniche hanno mostrato che pazienti con NSCLC avanzato e con PS ≥ 2 hanno avuto tassi di sopravvivenza paragonabili con chemioterapia sia a base di platino che senza composti del platino. Inoltre, il trattamento chemioterapico senza composti del platino mostrava un profilo di tossicità meno severo rispetto al trattamento chemioterapico con composti del platino (10,11).
Per pazienti con PS ≥ 2, nessun trattamento è ampiamente accettato come standard e numerose opzioni terapeutiche sono disponibili: terapia di supporto senza chemioterapia; chemioterapia a singolo agente; chemioterapia combinata non basata su composti del platino; e chemioterapia combinata basata su composti del platino. È evidente che nuovi approcci antitumorali, con bassi profili di tossicità, capaci di dare benefici clinici, sono urgentemente richiesti per pazienti con NSCLC avanzato e con un basso PS.
In anni recenti, numerosi agenti biologici che inibiscono processi specifici in cellule tumorali sono stati valutati clinicamente (12). Inoltre, strategie biologiche capaci di prevenire danni del sistema immune, causati dalla chemioterapia, potrebbero aumentare potenzialmente il tempo di sopravvivenza nei pazienti con cancro del polmone trattati con chemioterapia. Una strategia antitumorale del genere è stata riportata da Di Bella et al., che utilizzarono un singolo agente chemioterapeutico, la ciclofosfamide, insieme a composti biologici come la somatostatina, i retinoidi, la melatonina, la vitamina D e la bromocriptina (13).
Recentemente, è stato mostrato che l'associazione di ciclofosfamide, somatostatina, bromocriptina, retinoidi, melatonina e ACTH è ben tollerata ed efficace nel trattamento del linfoma non-Hodgkin a basso grado avanzato (14). Il razionale per questa associazione farmacologica può essere riassunto come segue: primo, il rilascio dell'ormone di crescita (GH) e della prolattina (PRL), due ormoni coinvolti nella crescita neoplastica, può essere inibito, rispettivamente, dalla somatostatina e dalla bromocriptina (15); secondo, i retinoidi, come la vitamina A ed i suoi analoghi, regolano la crescita e la differenziazione cellulare così come la funzione immune (16); terzo, la melatonina è dotata di proprietà immuno-stimolanti (17). Inoltre, ognuno degli agenti bioterapeutici proposti ha effetti antitumorali specifici. In particolare è stato dimostrato che recettori specifici per la somatostatina (SSTR) possono essere espressi da cellule tumorali polmonari (18) ed, inoltre, la somatostatina ed i suoi analoghi inibiscono l’angiogenesi tumorale indirettamente, mediante l’inibizione di fattori di crescita come il fattore di crescita endoteliale vascolare (VEGF) ed il fattore di crescita dei fibroblasti basico (bFGF) (19). Come risultato, è stato riportato che il trattamento con analoghi della somatostatina può indurre una significativa inibizione della crescita di tumori polmonari, sia SSTR-positivi che SSTR-negativi, in vivo (18).
Per quanto riguarda i retinoidi, essi sono capaci di inibire la crescita ed indurre apoptosi in molti tipi diversi di cellule tumorali (20).
È stata riportata una moderata attività antitumorale dell’acido 13-cis-retinoico (13cRA) o dell’acido all-trans retinico (ATRA), come singoli agenti, in piccoli gruppi di pazienti con cancro polmonare, già precedentemente pre-trattati. Risultati più incoraggianti derivano da studi di combinazione, in cui i retinoidi, specialmente l’ATRA, sono stati aggiunti o all’interferone-alfa o alla chemioterapia e radioterapia (20). L'utilità della melatonina come un nuovo agente per il trattamento antineoplastico negli esseri umani è ormai stata riconosciuta (21,22). I meccanismi antitumorali della melatonina includono l’attività antiproliferativa, effetti immuno-stimolatori sulle difese antitumorali dell’ospite e proprietà antiossidanti (23). In pazienti con NSCLC, la concomitante somministrazione di melatonina può migliorare l'efficacia della chemioterapia in termini sia di sopravvivenza che di qualità della vita (24).
I composti della vitamina D sono potenti agenti antiproliferativi in un’ampia varietà di tipi di cellule maligne, comprese quelle del cancro del polmone. I loro effetti anti-neoplastici sono associati ad un aumento nell’arresto in fase G0/G1 del ciclo cellulare, induzione di apoptosi e differenziazione e modulazione dell'espressione di fattori di crescita (25). In particolare, il calcitriolo (1alpha, 25-dihydroxyvitamin D3), il metabolita attivo della vitamina D, potenzia gli effetti antitumorali di molti agenti citotossici ed inibisce la motilità e l’invasività delle cellule tumorali, così come la formazione di nuovi vasi sanguigni (26). L'obiettivo di questo studio era di valutare la sopravvivenza, i benefici clinici e la tossicità di un regime terapeutico combinato, basato su somatostatina, retinoidi, melatonina, vitamina D, bromocriptina e ciclofosfamide in pazienti con NSCLC avanzato e basso Performance Status (ECOG PS ≥ 2), non trattati precedentemente con alcun regime chemioterapico.
MATERIALI E METODI
Selezione dei pazienti
I pazienti dovevano avere una diagnosi documentata istologica o citologica di NSCLC avanzato, stadio IIIB o stadio IV. Tutti i pazienti dovevano avere un PS ≥ 2 secondo la scala ECOG. Nessuna precedente chemioterapia, chirurgia o radioterapia toracica era permessa per l'eleggibilità. Altri criteri di eleggibilità erano: età ≥ 18 anni e malattia misurabile o valutabile bidimensionale. Il consenso informato scritto è stato ottenuto da ogni paziente prima dell’inizio del trattamento.
Trattamento
Il trattamento medico comprendeva una combinazione di somatostatina, retinoidi, melatonina, vitamina D, bromocriptina e ciclofosfamide. La somatostatina era somministrata sottocute ad una dose variabile di 1-3 mg/giorno entro 8-10 ore, utilizzando una siringa temporizzata. La somministrazione iniziava almeno tre ore dopo la cena. I retinoidi (ATRA, vitamina A palmitato e betacarotene a dosi di 5 mg, 5000 Ul e 20 mg/giorno, rispettivamente, in 5 ml di vitamina E) erano somministrati oralmente, alle 8 del mattino, prima della colazione. La melatonina era somministrata oralmente ad una dose di 20 mg/giorno, due volte al giorno (10 mg alle 14:00 ed alle 21:00). La vitamina D (dihydrotachysterol) era somministrata oralmente ad una dose di 0.3 mg/di giorno, alle 8 del mattino, prima della colazione. La bromocriptina era somministrata oralmente ad una dose di 2.5 mg/giorno, due volte al giorno (1.25 mg alle 14:00 ed alle 21:00).
Infine, la ciclofosfamide era somministrata oralmente ogni giorno alla dose di 50 mg (alle 14:00) o 100 mg (alle 14:00 ed alle 21:00), sulla base della conta cellulare ematica del paziente. I pazienti hanno ricevuto questo regime combinato ogni giorno senza interruzione, per un periodo indeterminato, a meno che si verificasse una tossicità inaccettabile.
Valutazione del paziente
La valutazione di base ha incluso la storia medica e l’esame clinico, l’elettrocardiogramma, l’esame mediante raggi X e TAC del torace ed ecografia dell’addome superiore. Le indagini di laboratorio hanno incluso conte ematiche complete, esame delle urine ed esami della funzione epatica e renale. Altre modalità di immagine, come la scintigrafia ossea e la risonanza magnetica, sono state eseguite secondo indicazioni cliniche specifiche. Tutta la valutazione di base è stata eseguita entro 1 mese prima dell'entrata in studio del paziente. Conte ematiche complete e differenziali ed analisi biochimiche venivano eseguiti ogni 2 settimane per valutare i parametri ematologici ed i livelli di fosfatasi alcalina, alanine aminotransferasi, aspartato aminotransferasi, bilirubina, creatinina sierica, elettroliti, magnesio, calcio e proteine. Follow-up regolare era eseguito ogni 2-3 mesi.
L’obiettivo principale di questo studio di fase II era di valutare la sopravvivenza generale, che era misurata dal primo giorno di trattamento alla data di morte o ultimo follow-up. Gli obiettivi secondari erano la valutazione della qualità della vita e la tossicità. I miglioramenti sintomatici, inclusa la tosse, la dispnea ed il dolore sono stati valutati dalla revisione della storia clinica durante le consultazioni medico-paziente. Gli effetti tossici sono stati valutati secondo i criteri sviluppati dall'Organizzazione Mondiale della Sanità (OMS).
L'efficacia clinica è stata analizzata secondo un'analisi “intenzione al trattamento” (intent-to-treat;ITT). La statistica descrittiva è stata riportata come proporzioni e mediane. Le curve di sopravvivenza sono state calcolate mediante il metodo di Kaplan-Meier.
RISULTATI
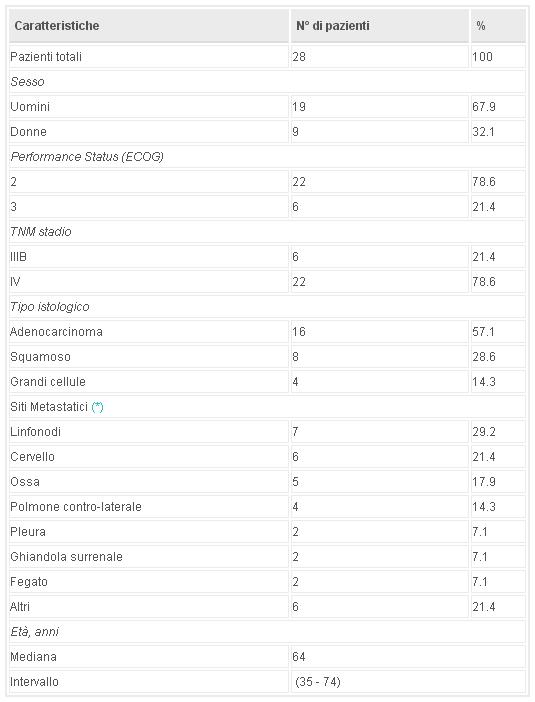
Ventotto pazienti eleggibili consecutivi (19 uomini e 9 donne) hanno preso parte allo studio, tra maggio 1995 e febbraio 2002. Le caratteristiche dei pazienti sono elencate in Tabella 1. L'età mediana era 64 anni (intervallo: 35 - 74 anni). Sedici pazienti (57.1%) avevano un adenocarcinoma, 8 pazienti (28.6%) avevano un carcinoma a cellule squamose e 4 pazienti (14.3%) avevano un carcinoma a grandi cellule. Ventidue pazienti (78.6%) avevano un ECOG PS di 2 e 6 pazienti (21.4%) avevano un ECOG PS di 3. Gli stadi TNM erano come segue: 6 pazienti stadio IIIB (21.4%) e 22 pazienti stadio IV (78.6%). I siti più comuni di metastasi erano ai linfonodi, al cervello, alle ossa ed al polmone contro-laterale.
Tabella 1
Tutti i pazienti erano valutabili per la risposta. Secondo l’analisi ITT la sopravvivenza generale mediana era 12,9 mesi (intervallo 1.5 - 33.5 months) (Figura 1). I tassi di sopravvivenza a 1 e 2 anni erano il 51.2% (95% CI, 31.0-68.2) ed il 21.1% (95% CI, 7.0-40.2), rispettivamente (Figura 1). C’era un miglioramento nei sintomi sia respiratori che generali. La tosse e la dispnea erano migliorate nell'80% e nel 70% dei pazienti, rispettivamente. Il dolore toracico e quello in generale migliorarono nella maggioranza dei pazienti, con riduzione del consumo di analgesici. Altri sintomi come emottisi, fatica ed insonnia erano anche migliorati nella maggior parte dei pazienti.
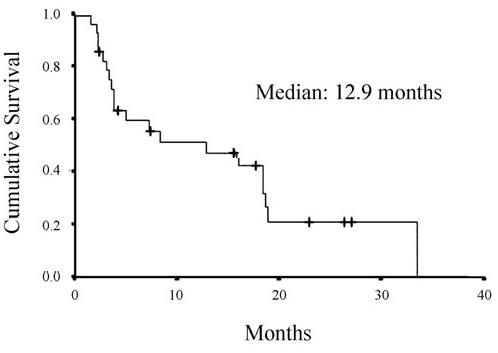
Curva di sopravvivenza generale. Eventi 20 (71.4%); censurati 8 (28.6%; indicati da “ + “).
Tutti i pazienti erano valutabili per la tossicità. Non è stata osservata nessuna morte dovuta al trattamento. C'era una tolleranza molto buona del regime combinato in pazienti con PS sia di 2 che 3. Inoltre, la maggior parte dei pazienti ha effettuato il trattamento a domicilio. I principali episodi di tossicità erano riferibili a sintomi gastro-intestinali (Table 2).
Tabella 2 -
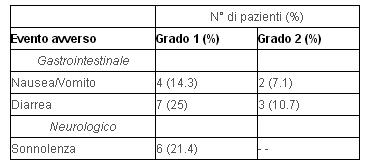
Il trentasei per cento dei pazienti ebbe diarrea di grado 1 (7 casi) o grado 2 (3 casi). Il ventuno per cento dei pazienti ebbe nausea o vomito di grado 1 (4 casi) o grado 2 (2 casi). Il ventuno per cento dei pazienti (6 casi) ebbe sonnolenza di grado 1. Questi leggeri effetti collaterali non hanno richiesto l'interruzione del trattamento, ma solo una riduzione della dose di somatostatina impiegata ed un cambio della modalità di somministrazione giornaliera della melatonina, cioè la dose di 20mg/giorno è stata suddivisa in tre somministrazioni invece che di due.
DISCUSSIONE
Questo studio riporta che pazienti con NSCLC in fase avanzata, con uno scarso PS e non precedentemente sottoposti a chemio-radioterapia o chirurgia, trattati con una combinazione di somatostatina, retinoidi, melatonina, vitamina D, bromocriptina e ciclofosfamide, hanno avuto una sopravvivenza generale mediana di 12.9 mesi, con tassi di sopravvivenza a 1 e 2 anni del 51,2% e del 21,1%, rispettivamente. C'era anche un miglioramento dei sintomi sia respiratori che generali, mentre gli effetti tossici erano molto modesti.
Il Performance Status è un importante fattore prognostico per la sopravvivenza nei pazienti con NSCLC avanzato (6,7). I pazienti valutati come ECOG PS ≥ 2 sono considerati avere una scarsa prognosi ed essi possono costituire dal 30% al 40% della popolazione di pazienti a cui viene diagnosticato un cancro del polmone (27). Questi pazienti hanno una qualità di vita significativamente indebolita con dispnea, dolore, emottisi, fatica, anoressia e cachessia. La sopravvivenza generale mediana di pazienti con scarso PS è sempre più breve di quella di pazienti con PS di 0-1. Quando trattati con terapia di supporto, inclusa una radioterapia palliativa, corticosteroidi, antibiotici, analgesici, antiemetici e trasfusioni, i pazienti con NSCLC avanzato hanno una sopravvivenza mediana di 2-3 mesi o 4-5 mesi, in PS ≥ 2 o PS di 0-1, rispettivamente (28,29). Un peggiore PS è caratterizzato anche da tassi di risposta inferiori alla chemioterapia. In 1960 pazienti, trattati con chemioterapia basata sul cisplatino, tra 1981 ed il 1994, i tempi di sopravvivenza mediani erano 9.4, 6.4 e 3.3 mesi in pazienti con PS di 0, 1 e 2, rispettivamente (28). Allo stesso modo, nella sperimentazione “1594 ECOG”, che comparava quattro regimi di combinazione del platino in 1155 pazienti, i tempi di sopravvivenza mediana erano 10.8, 7.1 e 4.1 mesi, con un tasso di sopravvivenza ad 1 anno del 42%, del 30% e del 19% in pazienti con PS di 0, 1 e 2, rispettivamente (30). In anni recenti, per ridurre la tossicità di regimi contenenti il platino, sono state eseguite numerose sperimentazioni randomizzate su regimi di chemioterapia senza platino. Per la monoterapia con il paclitaxel la sopravvivenza mediana per pazienti con PS ≥ 2 era di 4.1 mesi rispetto ai 2.9 mesi della terapia di supporto (28). La monoterapia con vinorelbine è risultata avere una sopravvivenza equivalente (mediana di 18 settimane), con meno tossicità rispetto alla combinazione di vinorelbine con cisplatino, in pazienti con PS ≥ 2 (9). Per la terapia combinata paclitaxel e gemcitabina, la sopravvivenza mediana per pazienti con PS ≥ 2 è stata di 4.8 mesi rispetto ai 10.2 mesi per pazienti con un buon PS di 0-1 (31).
L’obiettivo primario di questo studio era di valutare l’efficacia, in termini di sopravvivenza, di un nuovo approccio terapeutico basato su una combinazione di agenti bioterapeutici con la ciclofosfammide. Comparati ai dati di letteratura sopra citati, i risultati ottenuti sembrano indicare l’efficacia di questo trattamento in pazienti con NSCLC avanzato e scarso PS. Inoltre, il miglioramento dei sintomi, sia respiratori che generali, indica anche un’efficacia del trattamento in termini di qualità della vita.
Uno dei risultati più significativi ottenuti in questo studio riguarda la tossicità molto lieve osservata, rispetto alle tossicità causate dai comuni regimi chemioterapeutici in uso. I severi effetti collaterali che caratterizzano i regimi chemioterapeutici con o senza platino (incluse le tossicità ematologiche e renali e l’ototossicità) spesso non possono essere sopportati da pazienti con NSCLC avanzato e scarso PS. Il nuovo regime proposto in questo studio può, perciò, essere una valida alternativa terapeutica per questo sottotipo di pazienti.
In conclusione, questo studio fornisce un’evidenza preliminare che il regime combinato di somatostatina, retinoidi, melatonina, vitamina D, bromocriptina e ciclofosfamide è attivo nel trattamento di pazienti con NSCLC avanzato e basso Performance Status (ECOG PS ≥ 2), non trattati precedentemente con radiochemioterapia o chirurgia, in termini sia di sopravvivenza che di qualità della vita e presenta effetti collaterali molto lievi.
REFERENCES
- Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol 2001;2:533-43.
- Mountain CF. Revisions in the International System for Staging Lung Cancer. Chest 1997;111:1710-7.
- Souquet PJ, Chauvin F, Boissel JP, Cellerino R, Cormier Y, Ganz PA, Kaasa S, Pater JL, Quoix E, Rapp E, et al. Polychemotherapy in advanced non small cell lung cancer: a meta- analysis. Lancet 1993;342:19-21.
- Chemotherapy in non-small cell lung ca ncer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Non-small Cell Lung Cancer Collaborative Group. Bmj 1995;311:899-909.
- Marino P, Pampallona S, Preatoni A, Canton i A, Invernizzi F. Chem otherapy vs supportive care in advanced non-small-cell lung cancer. Results of a meta-analy sis of the literature. Chest 1994;106:861-5.
- Albain KS, Crowley JJ, LeBlanc M, Livingston RB. Survival determinants in extensive-stage non-small-cell lung cancer: the So uthwest Oncology Group experience. J Clin Oncol 1991;9:1618-26.
- Takigawa N, Segawa Y, Okahara M, Maeda Y, Takata I, Kataoka M, Fujii M. Prognostic factors for patients with advanced non-small cell lung cancer: univariate and multivariate analyses including recursive partitioning and amalgamation. Lung Cancer 1996;15:67-77.
- Bunn PA, Jr. Chemotherapy for advanced no n-small-cell lung cancer: who, what, when, why? J Clin Oncol 2002;20:23S-33S.
- Soria JC, Brisgand D, Le Chevalier T. Do a ll patients with advanced non-small-cell lung cancer benefit from cisplati n-based combination therapy? Ann Oncol 2001;12:1667-70.
- Kosmidis P, Mylonakis N, Nicolaides C, Kalophonos C, Samantas E, Boukovinas J, Fountzilas G, Skarlos D, Economopoulos T, Ts avdaridis D, Papakostas P, Bacoyiannis C, 13 Dimopoulos M. Paclitaxel plus carboplatin vers us gemcitabine plus paclitaxel in advanced non-small-cell lung cancer: a phase III randomized trial. J Clin Oncol 2002;20:3578-85.
- Georgoulias V, Papadakis E, Alexopoulos A, Tsiafaki X, Rapti A, Veslemes M, Palamidas P, Vlachonikolis I. Platinum-based and non-plat inum-based chemotherapy in advanced non- small-cell lung cancer: a randomised multicentre trial. Lancet 2001;357:1478-84.
- Dy GK, Adjei AA. Novel targets for lung cancer therapy: part I. J Clin Oncol 2002;20:2881- 94.
- Di Bella L, Rossi MT, Scalera G. Perspectives in pineal functions. Prog Brain Res 1979;52:475-8.
- Todisco M, Casaccia P, Ro ssi N. Cyclophosphamide plus somatostatin, bromocriptin, retinoids, melatonin and ACTH in the treatment of low-grade non-Hodgkin's lymphomas at advanced stage: result s of a phase II trial. Cancer Biother Radiopharm 2001;16:171-7.
- Colao A, Lombardi G. Growth -hormone and prolactin excess. Lancet 1998;352:1455-61.
- Niles RM. Recent advances in the use of vitamin A (retinoids) in the prevention and treatment of cancer. Nutrition 2000;16:1084-9.
- Guerrero JM, Reiter RJ. Melatonin-immune system relationships. Curr Top Med Chem 2002;2:167-79.
- O'Byrne KJ, Schally AV, Thom as A, Carney DN, Steward WP . Somatostatin, its receptors and analogs, in lung cancer. Chemotherapy 2001;47 Suppl 2:78-108.
- Dasgupta P. Somatostatin analogues: multiple roles in cellular proliferation, neoplasia, and angiogenesis. Pharmacol Ther 2004;102:61-85.
- Toma S, Raffo P, Isnardi L, Palumbo R. Retinoids in lung cancer chemoprevention and treatment. Ann Oncol 1999;10 Suppl 5:S95-102.
- Lissoni P. Is there a role for melatonin in supportive care? Support Care Cancer 2002;10:110-6. 14
- Vijayalaxmi, Thomas CR, Jr., Reiter RJ, He rman TS. Melatonin: from basic research to cancer treatment clinics. J Clin Oncol 2002;20:2575-601.
- Conti A, Maestroni GJ. The clinical neuroimmunotherapeutic role of melatonin in oncology. J Pineal Res 1995;19:103-10.
- Lissoni P, Chilelli M, Villa S, Cerizza L, Tancini G. Five years survival in metastatic non- small cell lung cancer patients treated wi th chemotherapy alone or chemotherapy and melatonin: a randomized trial. J Pineal Res 2003;35:12-5.
- Banerjee P, Chatterjee M. An tiproliferative role of vitami n D and its analogs--a brief overview. Mol Cell Biochem 2003;253:247-54.
- Trump DL, Hershberger PA, Bernardi RJ, Ahmed S, Muindi J, Fakih M, Yu WD, Johnson CS. Anti-tumoural activity of calcitriol: pre-clinical and clinical studies. J Steroid Biochem Mol Biol 2004;89-90:519-26.
- Kelly K. Challenges in defining and identifying patients with non-small cell lung cancer and poor performance status. Semin Oncol 2004;31:3-7.
- Blackhall FH, Bhosle J, That cher N. Chemotherapy for advanced non-small cell lung cancer patients with performance status 2. Curr Opin Oncol 2005;17:135-9.
- Clinical practice guidelines for the treatm ent of unresectable non-small-cell lung cancer. Adopted on May 16, 1997 by the Americ an Society of Clinical Oncology. J Clin Oncol 1997;15:2996-3018.
- Schiller JH, Harrington D, Belani CP, Langer C, Sandler A, Krook J, Zhu J, Johnson DH. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med 2002;346:92-8.
- Isla D, Rosell R, Sanchez JJ, Carrato A, Felip E, Camps C, Artal A, Gonzalez-Larriba JL, Azagra P, Alberola V, Martin C, Massuti B. Phase II trial of paclitaxel plus gemcitabine in patients with locally advanced or me tastatic non-small-cell lung cancer. J Clin Oncol 2001;19:1071-7.

